2021-2022學年青海省西寧市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題2分,共30分)第1題
-
1.可逆反應aA(s)+bB(g)?cC(g)+dD(g)進行過程中,當其他條件不變時,C的體積分數C%與溫度(T)、壓強(p)的關系如圖所示。下列敘述正確的是( )
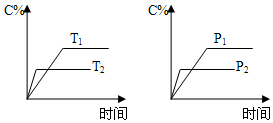
A.達到平衡后,加入催化劑,C的體積分數增大 B.達到平衡后,升高溫度,平衡向逆方向移動 C.化學方程式中,b>c+d D.達到平衡后,增加A的量,平衡向右移動 組卷:103引用:9難度:0.5 -
2.已知4NH3+5O2?4NO+6H2O,若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正確的關系是( )
A.4 v(NH3)=5v(O2) B.5v(O2)=6v(H2O) C.4v(NH3)=6 v(H2O) D.4v(O2)=5 v(NO) 組卷:55引用:4難度:0.9 -
3.在某一化學反應中,反應物A的濃度在2s內由1.0mol/L變成0.2mol/L,則在這2s內它的平均反應速率為( )
A.0.08mol/(L?s) B.0.8mol/(L?s) C.0.4mol/(L?s) D.0.04mol/L 組卷:89引用:4難度:0.7 -
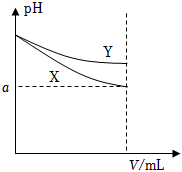 4.如圖中表示兩種等體積的堿性溶液在稀釋過程中pH的變化,下列相關說法正確的是( )
4.如圖中表示兩種等體積的堿性溶液在稀釋過程中pH的變化,下列相關說法正確的是( )A.兩溶液稀釋相同倍數,水電離的OH-濃度可能X>Y,也可能是X<Y B.若圖中曲線分別表示CH3COONa溶液和NaClO溶液,則X為CH3COONa溶液[已知Ka(CH3COOH)>Ka(HClO)] C.加水稀釋到任何程度,圖中a一定大于7 D.若圖中曲線分別表示NaOH溶液和氨水,則起始時NaOH溶液濃度更大 組卷:56引用:4難度:0.5 -
5.下列說法正確的是( )
A.為減少中和滴定誤差,錐形瓶必須洗凈并烘干后才能使用 B.用長頸漏斗可分離四氯化碳和水的混合物 C.用剩的藥品能否放回原試劑瓶,應視具體情況而定 D.紙上層析法通常以濾紙作為惰性支持物,濾紙纖維上的羥基具有親水性,它所吸附的水作為流動相 組卷:13引用:1難度:0.8 -
6.N4是一種由四個氮原子組成的氮單質,常溫下為固體,結構和白磷類似,呈正四面體,與N2互為同素異形體。已知:斷裂1mol N-N和N≡N所需要的能量分別為154kJ/mol和946kJ/mol,下列說法錯誤的是( )
A.1molN4中含有6NAN-N B.N4(g)分解生成N2在任何溫度下均能自發進行 C.N2比N4穩定 D.該熱化學方程式為:N4(s)=2N2(g) ΔH=-968kJ?mol-1 組卷:13引用:2難度:0.7 -
7.如圖兩個裝置,有關敘述正確的是( )

A.裝置①是原電池,裝置②是電解池 B.裝置①中銅是負極,裝置②中銅是陽極 C.溶液的pH變化:①變小,②變大 D.裝置中產生的氣體:①氫氣,②氧氣 組卷:28引用:3難度:0.5 -
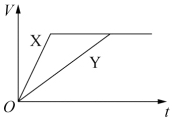 8.將足量且等量的形狀相同的鋅塊分別加入到等濃度等體積的兩份稀硫酸X、Y中,同時向X中加入少量飽和CuSO4溶液,發生反應生成氫氣的體積(V)與時間(t)的關系如圖所示,反應速率變快的原因是( )
8.將足量且等量的形狀相同的鋅塊分別加入到等濃度等體積的兩份稀硫酸X、Y中,同時向X中加入少量飽和CuSO4溶液,發生反應生成氫氣的體積(V)與時間(t)的關系如圖所示,反應速率變快的原因是( )A.CuSO4作催化劑 B.加入硫酸銅溶液增大了c(SO42-) C.加入硫酸銅溶液增大了溶液體積 D.Zn首先與Cu2+反應,生成的Cu與Zn、稀硫酸構成原電池 組卷:28引用:2難度:0.7
二、非選擇題(共70分)
-
25.某化學興趣小組為測定葡萄酒中SO2的含量,通過適當的方法使所含SO2全部逸出并用H2O2將其全部氧化為H2SO4,然后用NaOH標準溶液進行滴定。回答下列問題:
(1)寫出SO2氣體與H2O2溶液反應的化學方程式:。
(2)SO2在水中可形成SO2-飽和H2SO3溶液體系,此體系中含硫粒子有SO2、H2SO3、SO32-和。
(3)滴定前應先排出管內氣泡,圖中操作和儀器選擇均正確的是(填字母)。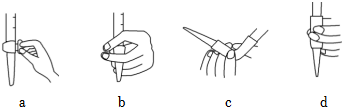
(4)若用50mL滴定管進行實驗,當滴定管中的液面在刻度“10”處,則管內液體的體積(填字母)。
a.=10mL
b.=40mL
c.<10mL
d.>40mL
(5)上述滴定實驗中,選用酚酞作指示劑,判斷反應達到終點的現象是。
(6)滴定終點讀數時俯視刻度線,則測量結果比實際值(填“偏高”“偏低”或“無影響”)。組卷:9引用:4難度:0.6 -
26.工業廢氣中CO的處理和合理利用,越來越受到關注。
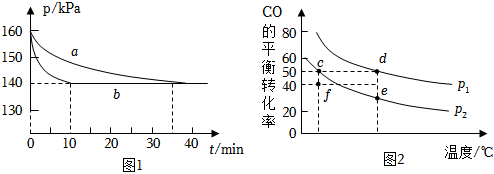
(1)在兩個固定容積為2L的恒容密閉容器中均充入2molCO和2molNO,在不同條件下發生反應2CO(g)+2NO(g)?2CO2(g)+N2(g),實驗測得反應體系的壓強與時間t的變化曲線如圖1所示。
①與實驗a相比,實驗b采取的措施可能是,理由是;
②0~10min內,實驗b對應條件下υ(NO)=;
③實驗a條件下,反應的平衡常數Kc=。
(2)CO和H2在一定條件下可以合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H。已知:υ(正)=k(正)?x(CO)?x2(H2),υ(逆)=k(逆)?x(CH3OH),其中x為各組分的體積分數。在密閉容器中按物質的量之比為1:2充入CO和H2,測得平衡混合氣體中CO的平衡轉化率隨溫度、壓強的變化關系如圖2所示。
①P1P2(填“>”“<”);升高溫度,k(正)k(逆)(填“增大”“減小”或“不變”);
②c、d、e三點平衡常數Kc、Kd、Ke三者之間的關系為,理由是;
③f點,=υ(正)υ(逆)(保留三位有效數字)。組卷:67引用:4難度:0.3


