2021-2022學(xué)年甘肅省張掖市高臺(tái)一中高二(下)月考化學(xué)試卷(3月份)
發(fā)布:2024/4/20 14:35:0
一、單項(xiàng)選擇題(共25小題,每小題2分,共50分)
-
1.下列說(shuō)法正確的是( )
A.p能級(jí)均含有3個(gè)相互垂直的紡錘形原子軌道 B.3d2表示3d能級(jí)有兩個(gè)軌道 C.每一個(gè)電子層中都含有s、p、d、f能級(jí) D.同一原子中可能存在兩個(gè)運(yùn)動(dòng)狀態(tài)完全相同的電子 組卷:73引用:3難度:0.7 -
2.下列說(shuō)法中正確的是( )
A.電子云示意圖中的每個(gè)小黑點(diǎn)都表示一個(gè)電子 B.鈉原子由1s22s22p63s1→1s22s22p63p1時(shí),釋放能量,由基態(tài)轉(zhuǎn)化成激發(fā)態(tài) C.第四周期最外層電子數(shù)為1,且內(nèi)層電子全部排滿的原子是鉀原子 D.C2H4分子中的碳原子為sp2雜化,其中C=C鍵是由兩個(gè)碳原子的sp2雜化軌道形成一個(gè)σ鍵和未參與雜化的p軌道形成一個(gè)π鍵構(gòu)成的 組卷:12引用:1難度:0.8 -
3.下列各對(duì)粒子中,分子的立體構(gòu)型相似的是( )
A.CS2與NO2 B.CCl4與PO43- C.SO2與O2 D.PCl3與BF3 組卷:19引用:1難度:0.8 -
4.下列分子或離子中鍵角由大到小排列的是( )
①BCl3②NH3③H2O④PCl4+⑤BeCl2A.⑤①④②③ B.⑤④①②③ C.④①②⑤③ D.③②④①⑤ 組卷:67引用:4難度:0.9 -
5.下列關(guān)于原子結(jié)構(gòu)與元素周期表的說(shuō)法正確的是( )
A.電負(fù)性最大的元素位于周期表的左下角 B.基態(tài)原子最外層電子排布為ns2的元素都位于周期表ⅡA C.某基態(tài)原子的電子排布式為[Ar]3d104s24p1,該元素位于周期表第四周期ⅢA D.基態(tài)原子p能級(jí)電子半充滿的原子第一電離能一定大于p能級(jí)有一對(duì)成對(duì)電子的 組卷:58引用:4難度:0.7 -
6.1817年,瑞典的貝采利烏斯從硫酸廠的鉛室底部的紅色粉狀物物質(zhì)中制得硒。硒是氧族元素,下列關(guān)于硒的基態(tài)原子說(shuō)法正確的有( )
①位于周期表p區(qū);
②電子占據(jù)17個(gè)原子軌道;
③有34種不同運(yùn)動(dòng)狀態(tài)的電子;
④占據(jù)8個(gè)能級(jí);
⑤電子占據(jù)的最高能層符號(hào)是4p;
⑥價(jià)電子為3d104s24p4A.3項(xiàng) B.4項(xiàng) C.5項(xiàng) D.6項(xiàng) 組卷:77引用:7難度:0.6 -
7.下列有關(guān)敘述正確的是( )
A.氫鍵是一種特殊化學(xué)鍵,它廣泛地存在于自然界中 B.在 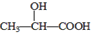 分子中含有1個(gè)手性C原子
分子中含有1個(gè)手性C原子C.碘單質(zhì)在水溶液中溶解度很小是因?yàn)镮2和H2O都是非極性分子 D.含氧酸可用通式XOm(OH)n來(lái)表示,若n值越大,則含氧酸的酸性越強(qiáng) 組卷:42引用:4難度:0.7 -
8.通常把原子總數(shù)和價(jià)電子總數(shù)相同的分子或離子稱為等電子體。人們發(fā)現(xiàn)等電子體的空間結(jié)構(gòu)相同,則下列有關(guān)說(shuō)法中正確的是( )
A.CH4和NH4+是等電子體,鍵角均為60° B.B3N3H6(B和N交替排列)和苯是等電子體,均有6mol非極性鍵 C.NH3和PCl3是等電子體,均為三角錐形結(jié)構(gòu) D.BF3和CO32-是等電子體,均為平面三角形結(jié)構(gòu) 組卷:111引用:4難度:0.8 -
9.下列說(shuō)法錯(cuò)誤的是( )
①雜化軌道可以形成σ鍵也可以形成π鍵
②π鍵不能單獨(dú)存在,一定要和σ鍵共存
③含有π鍵的化合物與只含σ鍵的化合物的化學(xué)性質(zhì)不同
④兩個(gè)非金屬元素的原子之間形成的化學(xué)鍵都是共價(jià)鍵
⑤NH3中N原子的sp3雜化軌道是由N原子的3個(gè)p軌道與H原子的s軌道雜化而成的
⑥成鍵的原子間已知軌道重疊越多,共價(jià)鍵越牢固
⑦1個(gè)N原子最多只能與3個(gè)H原子結(jié)合形成NH3分子,是由共價(jià)鍵的飽和性決定的A.①⑤ B.②⑥ C.③⑦ D.②④ 組卷:30引用:2難度:0.8 -
10.已知氯化鉻的水合物為CrCl3?6H2O,其中鉻元素的配位數(shù)是6,將含0.1 mol氯化鉻的水溶液用過(guò)量稀硝酸銀溶液處理時(shí),只得到0.2 mol AgCl沉淀,則氯化鉻溶于水中的含鉻陽(yáng)離子為( )
A.Cr3+ B.[CrCl2(H2O)4]+ C.[CrCl(H2O)5]2+ D.[Cr(H2O)6]3+ 組卷:241引用:8難度:0.7
二、填空題(共4小題,每小題12分,共60分)
-
29.某同學(xué)所做的有關(guān)銅元素的實(shí)驗(yàn)流程如圖:
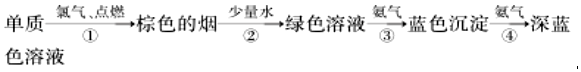
(1)Cu原子的價(jià)層電子的軌道表達(dá)式(電子排布圖)為。
(2)向深藍(lán)色溶液中加入適量乙醇,會(huì)析出深藍(lán)色晶體,該晶體中存在的化學(xué)鍵的類型有。該深藍(lán)色配離子空間構(gòu)型為。
(3)寫(xiě)出反應(yīng)④的離子方程式。
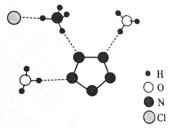
(4)氨基乙酸銅的分子結(jié)構(gòu)如圖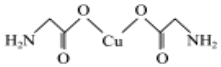 ,碳原子的雜化方式為 。
,碳原子的雜化方式為 。
(5)N元素的最簡(jiǎn)單氫化物易溶于水的原因是。
(6)元素的基態(tài)氣態(tài)原子得到一個(gè)電子形成氣態(tài)負(fù)一價(jià)離子時(shí)所放出的能量稱作第一電子親和能(E1)。第二周期部分元素的E1變化趨勢(shì)如圖(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈現(xiàn)異常的原因是。
(7)NF3與NH3的空間構(gòu)型相同,但NF3不易與Cu2+等形成配位鍵,其原因是:。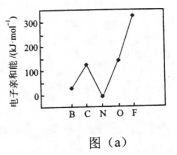 組卷:37引用:2難度:0.7
組卷:37引用:2難度:0.7
三、附加題
-
 30.(1)鋅和鎘位于同副族,而鋅與銅相鄰。現(xiàn)有 4 種銅、鋅元素的相應(yīng)狀態(tài),
30.(1)鋅和鎘位于同副族,而鋅與銅相鄰。現(xiàn)有 4 種銅、鋅元素的相應(yīng)狀態(tài),
①鋅:[Ar]3d104s2
②鋅:[Ar]3d104s1
③銅:[Ar]3d104s1
④銅:[Ar]3d10
失去 1 個(gè)電子需要的能量由大到小排序是。 (請(qǐng)使用序號(hào)填寫(xiě))
(2)銅能與類鹵素(SCN) 2反應(yīng)生成Cu(SCN) 2,1 mol(SCN)2分子中含有的δ鍵數(shù)目為,類鹵素(SCN)2 對(duì)應(yīng)的酸有兩種,理論推測(cè)硫氰酸(H-S-C=N)的沸點(diǎn)低于異硫氰酸(H-N=C=S)的沸點(diǎn),其原因是;寫(xiě)出SCN-的等電子體(離子和分子各寫(xiě)一個(gè),用化學(xué)式表示)。
(3)我國(guó)科學(xué)家最近成功合成了世界上首個(gè)五氮陰離子鹽(N5)6(H3O)3(NH4)4Cl(用R代表)。經(jīng)X射線衍射測(cè)得化合物R的晶體結(jié)構(gòu),其局部結(jié)構(gòu)如圖所示。
①?gòu)慕Y(jié)構(gòu)角度分析,R中兩種陽(yáng)離子的相同之處為,不同之處為。(填標(biāo)號(hào))
A.中心原子的雜化軌道類型
B.中心原子的價(jià)層電子對(duì)數(shù)
C.立體結(jié)構(gòu)
D.共價(jià)鍵類型
②R中陰離子N5-中的σ鍵總數(shù)為個(gè)。分子中的大π鍵可用符號(hào)Πmn表示,其中m代表參與形成大π鍵的原子數(shù),n代表參與形成大π鍵的電子數(shù)(如苯分子中的大π鍵可表示為Π66),則N5-中的大π鍵應(yīng)表示為。
③如圖中虛線代表氫鍵,其表示式為(NH4+)N?H???Cl、、。組卷:57引用:1難度:0.6


