2015-2016學(xué)年安徽省六安市舒城中學(xué)高三(上)化學(xué)寒假作業(yè)(3)
發(fā)布:2024/11/27 13:0:2
一、選擇題(每題只有一個正確答案,共54分)
-
1.X、Y、Z、W是分別位于第2、3周期的元素,原子序數(shù)依次遞增.X與Z位于同一主族,Y元素的單質(zhì)既能與鹽酸反應(yīng)也能與NaOH溶液反應(yīng),Z原子的最外層電子數(shù)是次外層電子數(shù)的一半,Y、Z、W原子的最外層電子數(shù)之和為14.下列說法正確的是( )
A.室溫下,0.1 mol/LW的氣態(tài)氫化物的水溶液的pH>1 B.Z的最高價氧化物能與水反應(yīng)生成相應(yīng)的酸 C.Y單質(zhì)在一定條件下可以與氧化鐵發(fā)生置換反應(yīng) D.原子半徑由小到大的順序:X<Y<Z<W 組卷:15引用:6難度:0.7 -
2.以下對核外電子運動狀況的描述正確的是( )
A.同一原子中,2p,3p,4p能級的軌道依次增多 B.當(dāng)碳原子的核外電子排布由 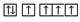 轉(zhuǎn)變?yōu)?img alt src="https://img.jyeoo.net/quiz/images/201302/23/01784853.png" style="vertical-align:middle" />時,這一過程中釋放能量
轉(zhuǎn)變?yōu)?img alt src="https://img.jyeoo.net/quiz/images/201302/23/01784853.png" style="vertical-align:middle" />時,這一過程中釋放能量C.3p2表示3p能級有兩個軌道 D.在同一能級上運動的電子,其運動狀態(tài)可能相同 組卷:145引用:15難度:0.7 -
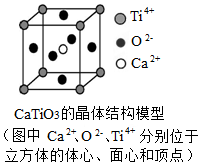 3.下列關(guān)于晶體的說法正確的組合是( )
3.下列關(guān)于晶體的說法正確的組合是( )
①分子晶體中都存在共價鍵
②在晶體中只要有陽離子就一定有陰離子
③金剛石、SiC、NaF、NaCl、H2O、H2S晶體的熔點依次降低
④離子晶體中只有離子鍵沒有共價鍵,分子晶體中肯定沒有離子鍵
⑤CaTiO3晶體中(晶胞結(jié)構(gòu)如圖所示)每個Ti4+和12個O2-相緊鄰
⑥SiO2晶體中每個硅原子與兩個氧原子以共價鍵相結(jié)合
⑦晶體中分子間作用力越大,分子越穩(wěn)定
⑧氯化鈉熔化時離子鍵被破壞.A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧ 組卷:81引用:28難度:0.9 -
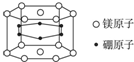 4.納米材料的表面粒子數(shù)占粒子總數(shù)的比例很大,這是它有許多特殊性質(zhì)的原因.假設(shè)某硼鎂化合物的結(jié)構(gòu)如圖所示(六個硼原子位于棱柱內(nèi)),則這種納米顆粒的化學(xué)式( )
4.納米材料的表面粒子數(shù)占粒子總數(shù)的比例很大,這是它有許多特殊性質(zhì)的原因.假設(shè)某硼鎂化合物的結(jié)構(gòu)如圖所示(六個硼原子位于棱柱內(nèi)),則這種納米顆粒的化學(xué)式( )A.Mg3B6 B.Mg14B6 C.MgB2 D.Mg5B12 組卷:62引用:3難度:0.9 -
5.如表中各粒子、粒子對應(yīng)的立體結(jié)構(gòu)及解釋均正確的是( )
分 子 立體結(jié)構(gòu) 原 因 A 甲醛(HCHO) 平面三角形 C原子采用sp2雜化且C原子的價電子均參與成鍵 B 三氯甲烷(CH3Cl) 正四面體 C原子采用sp3雜化且C原子的價電子均參與成鍵 C 銨根離子(NH4+) 三角錐型 N原子采用sp3雜化且4個N-H完全一樣 D 水分子(H2O) 直線型 O原子采用sp3雜化但O原子有兩對價電子未參與成鍵 A.A B.B C.C D.D 組卷:42引用:3難度:0.9 -
6.根據(jù)下列短周期元素性質(zhì)的數(shù)據(jù)判斷,下列說法正確的是( )
元素編號
元素性質(zhì)① ② ③ ④ ⑤ ⑥ ⑦ ⑧ 原子半徑/10-10m 0.74 1.60 1.52 1.10 0.99 1.86 0.75 1.43 最高或最低化合價 +2 +1 +5 +7 +1 +5 +3 -2 -3 -1 -3 A.元素⑦位于第3周期ⅤA族 B.元素⑤⑥形成的化合物是共價化合物 C.元素①⑧形成的化合物具有兩性 D.元素③的最高價氧化物對應(yīng)水化物堿性最強 組卷:15引用:3難度:0.9 -
7.下列實驗方案、現(xiàn)象和結(jié)論均正確的是( )
選項 實驗方案 現(xiàn)象 結(jié)論 A 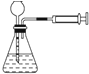
向里推活塞時,長頸漏斗中有一段水柱,靜止,水柱高度不變 該裝置的氣密性良好 B 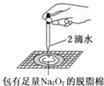
脫脂棉燃燒 Na2O2與水反應(yīng)生成氫氧化鈉和氧氣 C 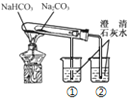
燒杯①的澄清石灰水先變渾濁 NaHCO3比Na2CO3受熱更易分解 D 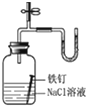
U形管右端的液面高 鐵釘發(fā)生吸氧腐蝕 A.A B.B C.C D.D 組卷:38引用:8難度:0.9 -
8.汞(熔點-39℃,沸點356℃)是制造電池、電極的重要原料,歷史上曾用“灼燒辰砂法”制取汞.目前工業(yè)上制粗汞的一種流程圖如圖.下列分析錯誤的是( )

A.洗滌粗汞可用5%的鹽酸代替5%的硝酸 B.辰砂與氧化鈣加熱反應(yīng)時,CaSO4為氧化產(chǎn)物 C.“灼燒辰砂法”過程中電子轉(zhuǎn)移的方向和數(shù)目可表示為: 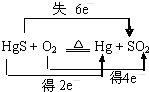
D.減壓蒸餾的目的是降低汞的沸點,提高分離效率 組卷:57引用:4難度:0.7
二、填空題(滿分46分)
-
23.三氯化磷(PCl3)是一種重要的摻雜劑。實驗室要用黃磷(即白磷)與干燥的Cl2模擬工業(yè)生產(chǎn)制取PCl3,裝置如圖所示:(部分夾持裝置略去)
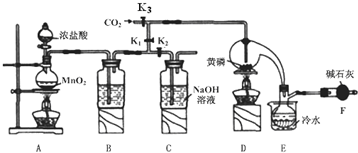
已知:①黃磷與少量Cl2反應(yīng)生成PCl3,與過量Cl2反應(yīng)生成PCl5;
②PCl3遇水會強烈水解生成 H3PO3和氣體;
③PCl3遇O2會生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸點見下表:
請回答下列問題:物質(zhì) 熔點/℃ 沸點/℃ PCl3 -112 75.5 POCl3 2 105.3
(1)B中所裝試劑是。
(2)F中堿石灰的作用是。
(3)實驗時,檢查裝置氣密性后,先打開K3通入干燥的CO2,再迅速加入黃磷。通干燥CO2的作用是。
(4)粗產(chǎn)品中常含有POC13、PCl5等。加入黃磷加熱除去PCl5后,通過(填實驗操作名稱),即可得到較純凈的PCl3。
(5)實驗結(jié)束時,可以利用C中的試劑吸收多余的氯氣,C中反應(yīng)的離子方程式為。
(6)通過下面方法可測定產(chǎn)品中PCl3的質(zhì)量分?jǐn)?shù):
①迅速稱取1.00g產(chǎn)品,加水反應(yīng)后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反應(yīng);
③向②所得溶液中加入幾滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重復(fù)②、③操作,平均消耗0.1000mol/L Na2S2O3溶液8.40mL。
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根據(jù)上述數(shù)據(jù),假設(shè)測定過程中沒有其他反應(yīng),該產(chǎn)品中PCl3的質(zhì)量分?jǐn)?shù)為。組卷:4引用:1難度:0.5 -
24.物質(zhì)結(jié)構(gòu)及晶體知識是高中化學(xué)掌握的重點知識,請完成下列各題:
(1)在基態(tài)14C原子中,核外存在對自旋相反的電子;
(2)已知:硫酸銅溶液中滴入氨基乙酸鈉(H2N-CH2-COONa)即可得到配合物A.其結(jié)構(gòu)如圖1: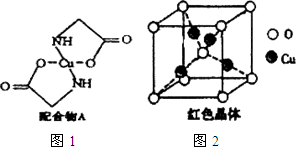
①Cu元素基態(tài)原子的電子排布式為。
②配合物A中碳原子的軌道雜化類型為,配合物A中不存在。
A.極性鍵 B.非極性鍵 C.氫鍵 D.s鍵 E.p鍵 F.離子鍵
③已知:硫酸銅灼燒可以生成一種紅色晶體,其結(jié)構(gòu)如圖2,則該化合物的化學(xué)式是,銅離子的配位數(shù)是。
(3)如圖為幾種晶體或晶胞的構(gòu)型示意圖。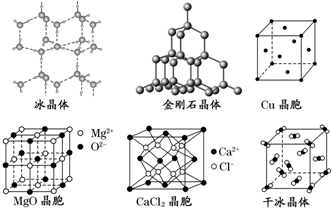
①冰、金剛石、MgO、CaCl2、干冰5種晶體的熔點由高到低的順序為。
②NaCl晶胞與MgO晶胞相同,NaCl晶體的晶格能(填“大于”或“小于”)MgO晶體的晶格能,原因是。
③每個銅晶胞中實際占有個銅原子,CaCl2晶體中Ca2+的配位數(shù)為。
④冰的熔點遠高于干冰,除因為H2O是極性分子、CO2是非極性分子外,還有一個重要的原因是。組卷:14引用:1難度:0.3


