2020-2021學年山東省濱州市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題包括10小題,每小題2分,共20分.每小題只有一個選項符合題意.
-
1.化學與生產、生活密切相關.下列說法正確的是( )
A.銨態氮肥與草木灰混合使用可降低肥效 B.侯德榜制堿的工藝流程中,向飽和食鹽水中先通入二氧化碳,再持續通入氨氣 C.一次性鋅錳堿性干電池能實現化學能與電能的相互轉化 D.反應Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O能自發進行,則該反應的△H<0 組卷:26引用:1難度:0.7 -
2.下列說法錯誤的是( )
A.同一原子中,1s、2s、3s電子的能量逐漸升高 B.霓虹燈能發出五顏六色的光,其發光機制與氫原子光譜形成的機制基本相同 C.2p和3p軌道在三維空間分布的圖形均為啞鈴 D.電子云示意圖中的每個小黑點都表示一個電子 組卷:98引用:3難度:0.7 -
3.室溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.中性溶液:Fe3+、NH4+、Cl-、CH3COO- B.使甲基橙變紅的溶液:Fe2+、Na+、MnO4-、I- C. =10-12的溶液:K+、Al3+、Cl-、SO42-Kwc(H+)D.含有Ca2+的溶液:Na+、K+、CO32-、NO3- 組卷:28引用:2難度:0.6 -
4.目前人工固氮普遍采用的是氨的工業合成。化學家GethardErtl證實了氫氣與氮氣在固體催化劑表面合成氨的過程,如圖所示。下列說法錯誤的是( )
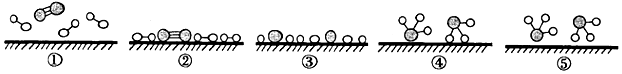
A.②→③需要吸收能量 B.為了提高氨的脫附速率,應適時地將氨從反應后的混合氣體中分離出來 C.該過程中包含舊化學鍵的斷裂和新化學鍵的生成 D.該催化劑可提高反應物的平衡轉化率 組卷:69引用:2難度:0.8 -
5.下列說法正確的是( )
A.使用pH試紙測定溶液pH時,應先用蒸餾水潤濕試紙 B.除去MgCl2溶液中少量的Fe3+,可加入過量MgO粉末,充分反應后過濾 C.0.1mol?L-1醋酸溶液,在加水稀釋過程中,溶液中所有離子的濃度均減小 D.實驗室用帶有磨口玻璃塞的試劑瓶盛放Na2CO3溶液 組卷:40引用:3難度:0.7 -
6.關于下列裝置說法錯誤的是( )
A. 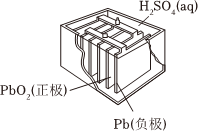
如圖裝置放電過程中,硫酸濃度不斷降低B. 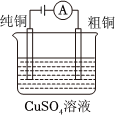
如圖裝置工作過程中,CuSO4溶液濃度減小C. 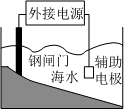
如圖裝置鋼閘門應與外接電源的正極相連來獲得保護D. 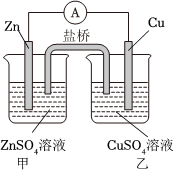
如圖裝置鹽橋中的Cl-移向甲燒杯組卷:51引用:2難度:0.7
三、非選擇題:本題共5小題,共60分.
-
19.合成氨是人類科學技術發展史上的一項重大突破。
(1)合成氨反應N2(g)+3H2(g)?2NH3(g),初始時氮氣、氫氣的體積比為1:3,在相同催化劑條件下,平衡混合物中氨的體積分數φ(NH3)與溫度、壓強的關系如圖1所示。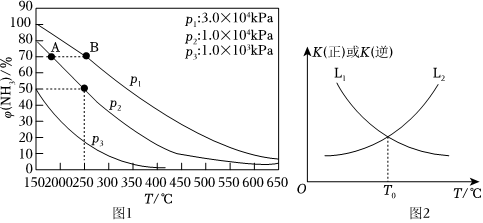
①A、B兩點的化學反應速率vA(NH3)vB(NH3)。(填“>”、“<”或“=”)
②在250℃、1.0×104kPa下,H2的平衡轉化率為%。(計算結果保留小數點后1位)
(2)隨著溫度升高,單位時間內NH3的產率增大,溫度高于900℃以后,單位時間內NH3的產率開始下降的原因可能是:升高溫度催化劑活性降低、。
(3)合成氨反應中,正反應速率v正=k正?c(N2)?c3(H2),逆反應速率v逆=k逆?c2(NH3),k正、k逆為速率常數.正反應和逆反應的化學平衡常數與溫度的關系如圖2所示。
①表示逆反應的平衡常數與溫度變化關系的曲線為。(填“L1”或“L2”)
②T0℃時,=k正k逆。
(4)研究表明金屬催化劑可加速氨氣的分解。表為某溫度下等質量的不同金屬分別催化等濃度氨氣分解生成氫氣的初始速率(mmol?min-1)。
①不同催化劑存在下,氨氣分解反應活化能最大的是催化劑 Ru Rh Ni Pt Pd Fe 初始速率 7.9 4.0 3.0 2.2 1.8 0.5 。(填催化劑的化學式)
②某溫度下,Ru作催化劑,向恒容密閉容器中通入2mol NH3,此時壓強為P0,若平衡時氨氣分解的轉化率為50%,該溫度下反應2NH3(g)?N2(g)+3H2(g)的平衡常數Kp=。(以分壓表示,分壓=總壓×物質的量分數)組卷:48引用:2難度:0.4 -
20.磁性材料產業是21世紀各國競相發展的高科技支柱產業之一,磁性材料廣泛用于電子信息、軍事技術等領域。碳酸錳主要用于制備軟磁鐵氧體,工業上用含錳廢水(主要金屬離子為Mn2+、Fe2+、Al3+,還含有少量Ca2+、Mg2+、Cu2+和Ni2+等離子)為原料,生產MnCO3的工藝流程如圖。
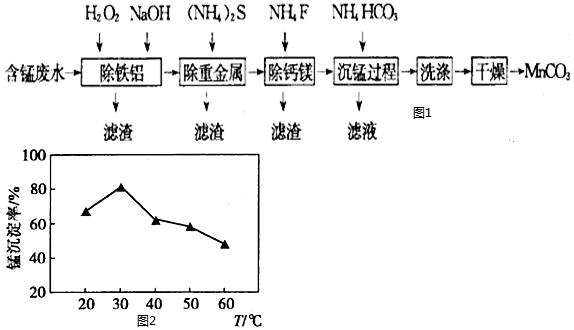
已知該條件下Ksp(CaF2)=4.0×10-9mol3?L-3、Ksp(MgF2)=7.5×10-11mol3?L-3。
(1)流程中含錳廢水經過前三步預處理,得到主要含有Mn2+的母液。
①除鐵鋁時,在攪拌條件下先加入H2O2溶液,再加入NaOH溶液調節pH。加入H2O2溶液時發生反應的離子方程式為。
②除重金屬時,濾渣的主要成分為。(填化學式)
③除鈣鎂時,為使Ca2+沉淀完全(當離子濃度降到1.0×10-5mol?L-1時,可視為沉淀完全),需控制溶液中NH4F的最低濃度為mol?L-1。
(2)沉錳過程在pH為7.0條件下充分進行,反應溫度對錳沉淀率的影響如圖所示。
①沉錳過程發生反應的離子方程式為。
②當溫度超過30℃,沉錳反應的錳沉淀率隨溫度升高而下降的原因是。
(3)沉錳后過濾得到MnCO3粗產品,依次用去離子水和無水乙醇各洗滌2~3次,再低溫干燥,得到純凈的MnCO3。用無水乙醇洗滌的目的是。
(4)測定碳酸錳產品的純度。
稱取0.5000g碳酸錳產品于錐形瓶中,加25.00mL磷酸,加熱,碳酸錳全部轉化為[Mn(PO4)2]3-,冷卻至室溫.加水稀釋至100mL,滴加2~3滴指示劑,然后用濃度為0.2000mol?L-1的硫酸亞鐵銨[(NH4)2Fe(SO4)2]標準溶液滴定(反應為[Mn(PO4)2]3-+Fe2+═Mn2++Fe3++2PO43-)。重復操作3次,記錄數據如表。則產品的純度=,若滴定終點時發現滴定管尖嘴處產生了氣泡,則測得的碳酸錳產品的純度。(填“偏高”、“偏低”或“無影響”)滴定次數 0.2000mol?L-1的硫酸亞鐵銨標準溶液讀數(mL) 滴定前 滴定后 1 0.10 20.20 2 1.32 21.32 3 1.05 20.95 組卷:36引用:2難度:0.5


