人教版(2019)選擇性必修1《1.1.1反應(yīng)熱及其測(cè)定》2020年同步練習(xí)卷
發(fā)布:2024/4/20 14:35:0
-
1.下列有關(guān)能量的判斷或表示方法正確的是( )
A.相同條件下,等物質(zhì)的量的硫蒸氣和硫固體分別完全燃燒,前者放出熱量更多 B.從C(石墨)=C(金剛石)△H=+1.9 kJ?mol-1,可知相同條件下金剛石比石墨更穩(wěn)定 C.由H+(aq)+OH-(aq)═ H2O(l)△H=-57.3 kJ?mol-1,可知:含1 molCH3COOH的稀溶液與含1 molNaOH的稀溶液混合,放出的熱量大于57.3 kJ D.2gH2完全燃燒生成液態(tài)水放出285.8kJ熱量,則表示氫氣燃燒的熱化學(xué)方程式為:2H2(g)+O2(g)═ 2 H2O(l)△H=-285.8 kJ?mol-1 組卷:44引用:5難度:0.6 -
2.2019年是“國(guó)際化學(xué)元素周期表年”。W、X、Y、Z均為短周期元素,原子序數(shù)依次增加,其中W、X、Z組成的化合物M、N、R之間存在如圖所示的反應(yīng)。下列敘述正確的是( )
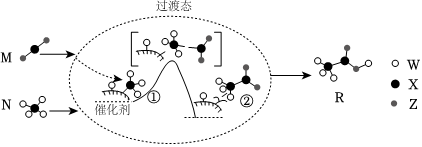
A.元素非金屬性的順序?yàn)閄>Y>Z>W(wǎng) B.M、N、R三種分子中,所有原子均滿足8電子穩(wěn)定結(jié)構(gòu) C.M、N、R三種分子均含有極性鍵和非極性鍵 D.W、X、Y、Z四種元素既可形成離子化合物,又可形成共價(jià)化合物 組卷:126引用:6難度:0.5 -
3.下列說(shuō)法中正確的是( )
A.分子中鍵能越大,鍵越長(zhǎng),則分子越穩(wěn)定 B.失電子難的原子獲得電子的能力一定強(qiáng) C.在化學(xué)反應(yīng)中,某元素由化合態(tài)變?yōu)橛坞x態(tài),該元素被還原 D.電子層結(jié)構(gòu)相同的不同離子,其半徑隨核電荷數(shù)增多而減小 組卷:350引用:16難度:0.9 -
4.下列說(shuō)法或表示方法正確的是( )
A.等質(zhì)量的硫蒸氣和硫固體分別完全燃燒,后者放出的熱量多 B.由C(s,石墨)═C(s,金剛石)△H=+119 kJ?mol-1可知,金剛石比石墨穩(wěn)定 C.在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1,若將含0.5 mol H2SO4的濃硫酸與含1 mol NaOH的稀溶液混合,放出的熱量大于57.3 kJ D.在25℃、101 kPa時(shí),2 g H2完全燃燒生成液態(tài)水,放出285.8 kJ熱量,氫氣燃燒的熱化學(xué)方程式表示為2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ?mol-1 組卷:25引用:6難度:0.7 -
5.已知1g氫氣完全燃燒生成水蒸氣時(shí)放出熱量121kJ,且氫氣中1mol H-H 鍵完全斷裂時(shí)吸收熱量436kJ,水蒸氣中1mol H-O 鍵形成時(shí)放出熱量463kJ,則氧氣中1mol O=O 鍵斷裂時(shí)吸收熱量為( )
A.188kJ B.248 kJ C.124kJ D.496kJ 組卷:12引用:5難度:0.7 -
6.H2O分子中每個(gè)O原子結(jié)合2個(gè)H原子的根本原因是( )
A.共價(jià)鍵的方向性 B.共價(jià)鍵的鍵長(zhǎng) C.共價(jià)鍵的鍵角 D.共價(jià)鍵的飽和性 組卷:80引用:8難度:0.9 -
7.下列依據(jù)熱化學(xué)方程式得出的結(jié)論正確的是( )
A.已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ?mol-1,則氫氣的燃燒熱為241.8kJ?mol-1 B.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ?mol-1,則含20.0gNaOH的稀溶液與稀醋酸完全中和,放出大于28.65kJ的熱量 C.已知C(石墨,s)=C(金剛石,s);△H>0,則石墨比金剛石穩(wěn)定 D.已知2C(s)+2O2(g)═2CO2(g)△H=a、2C(s)+O2(g)═2CO(g)△H=b,則a>b 組卷:40引用:3難度:0.7
-
20.某實(shí)驗(yàn)小組同學(xué)進(jìn)行如下實(shí)驗(yàn),以檢驗(yàn)化學(xué)反應(yīng)中的能量變化.請(qǐng)回答下列問(wèn)題:

(1)實(shí)驗(yàn)中發(fā)現(xiàn),反應(yīng)后①中的溫度,②中的溫度.(填“升高”或“降低”)
(2)上述反應(yīng)過(guò)程中的能量變化可用圖2表示的是。(填“①”或“②”)
(3)實(shí)驗(yàn)①中測(cè)得產(chǎn)生氣體的速率與時(shí)間的關(guān)系如圖3所示,則t2-t3反應(yīng)速率逐漸減小的主要原因是.
(4)寫(xiě)出①中發(fā)生反應(yīng)的離子方程式:.組卷:10引用:2難度:0.5 -
21.已知101kPa時(shí),1mol白磷(P4)固體轉(zhuǎn)化為紅磷,要放出29.2kJ的熱量.回答下列問(wèn)題:
(1)紅磷和白磷互為.相同條件下,白磷的穩(wěn)定性比紅磷的穩(wěn)定性。(填“強(qiáng)”或“弱”)
(2)白磷在一定條件下轉(zhuǎn)化為紅磷時(shí),斷裂舊化學(xué)鍵所吸收的能量(填“高”或“低”)于形成新化學(xué)鍵所放出的能量.
(3)已知白磷和P4O6的分子結(jié)構(gòu)如圖所示,現(xiàn)提供以下化學(xué)鍵的鍵能(kJ?mol-1):P-P198,P-O360,O=O496.則1mol P4(白磷)與O2反應(yīng)生成1mol P4O6(s)時(shí)填(“吸收”或“放出”)
kJ熱量. 組卷:12引用:1難度:0.6
組卷:12引用:1難度:0.6


