新人教版九年級下冊《11.1 生活中常見的鹽》2021年同步練習卷(10)
發布:2024/4/20 14:35:0
一、單選題(共10題;共20分)
-
1.“84消毒液”是賓館、醫院、學校等一些公共場所常備的消毒劑,適用于環境和物體表面消毒,其有效成分主要是次氯酸鈉(化學式為NaClO)。次氯酸鈉屬于( )
A.酸 B.堿 C.鹽 D.氧化物 組卷:80引用:5難度:0.5 -
2.在發酵的面團中加入下列某種物質的溶液揉和,既能除去面團中的酸,又能使蒸出的饅頭疏松多孔,該物質是( )
A.Na2CO3 B.Ca(OH)2 C.CaO D.NaCl 組卷:90引用:41難度:0.7 -
3.泉州是海上絲綢之路的起點,古代的染坊常用某種“堿劑”來精煉絲綢,其主要成分是一種鹽,水溶液呈堿性,它能使促進蠶絲表面的絲膠蛋白質水解而除去,從而使絲綢顏色潔白、質感柔軟、色澤光亮,這種“堿劑”可能是( )
A.食鹽 B.燒堿 C.草木灰 D.熟石灰 組卷:9引用:4難度:0.7 -
4.四瓶失去標簽的溶液分別為:①NaOH ②CuSO4 ③MgCl2 ④Na2SO4,不用其他任何試劑而要將它們一一檢驗出來的正確順序是( )
A.③①②④ B.②③①④ C.②①③④ D.①③②④ 組卷:707引用:15難度:0.7 -
5.某一無色溶液具有下列性質:①使無色酚酞試液變紅;②與CuSO4溶液反應可產生藍色沉淀;③與純堿溶液反應產生白色沉淀。此溶液是( )
A.氫氧化鈉溶液 B.澄清石灰水 C.氯化鈣溶液 D.鹽酸 組卷:393引用:22難度:0.9 -
6.下列有關“侯氏制堿法”的敘述中,不正確的是( )
氨堿法生產純堿的主要反應原理如下:NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl ②2NaHCO3Na2CO3+CO2↑+H2O.△A.加熱時的穩定性:碳酸鈉>碳酸氫鈉 B.用食鹽制純堿還需要含碳、氧元素的物質 C.配制飽和食鹽水時,可通過攪拌來提高食鹽的溶解度 D.向飽和食鹽中先通入氨氣的作用是使溶液呈堿性,促進二氧化碳的吸收 組卷:128引用:4難度:0.7
三、實驗探究題(共2題;共12分)
-
19.(A)某校化學興趣小組的同學學習了酸、堿、鹽的知識后,對課本中“酸、堿、鹽之間并不是都能發生復分解反應”這句話產生了興趣,展開了探究性學習.
(1)【提出問題】發生復分解反應應具備哪些條件?
(2)【活動探究】該小組同學進行以下四組實驗,發現均能反應,請寫出④的化學方程式:
①硝酸鋇溶液與稀硫酸 ②稀硫酸與碳酸鉀溶液 ③稀鹽酸與氫氧化鈉溶液④硝酸鋇溶液與碳酸鉀溶液:.
(3)【理論分析】上述反應為什么能夠發生?是因為在這些反應物的溶液中有特殊的陰、陽離子,它們兩兩結合生成了沉淀或氣體或水.如:
①中有Ba 2++SO42-→BaSO4↓ ②中有H ++CO32-→H2O+CO2↑
③中有H ++OH-→H2O ④中有兩種離子,所以才發生化學反應.
(4)【理論分析】經過分析,該小組同學得出以下結論:生成物中是否有沉淀或氣體或水,是判斷酸、堿、鹽之間能否發生復分解反應的主要條件.
(5)【形成網絡】按照一定的順序排列某些離子,就可以形成一種知識網絡.在網絡中,用“--”相連接的陰、陽離子間能兩兩結合生成沉淀或氣體或水.
現有Ca 2+、HCO3-兩種離子,請將它們填入下面合適的“ ”內,使其形成一個更為完整的復分解反應的知識網絡.
”內,使其形成一個更為完整的復分解反應的知識網絡.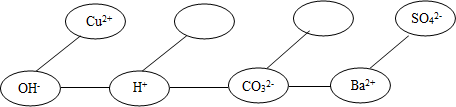
(B)探究物質性質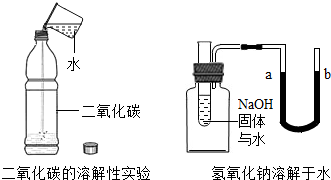
二氧化碳是否可以溶于水,很難直接觀察到現象,可以通過的變化來間接感知.同樣,研究氫氧化鈉溶解于水時是吸熱還是放熱,就是利用的變化引起了U形管內水位的變化,使(填a或b)處的水位升高的.組卷:52引用:8難度:0.3
四、計算題(共1題;共7分)
-
 20.純堿是一種重要的工業原料,鹽湖中的純堿常常會含有少量的氯化鈉(其它雜質忽略不計)。取6g純堿樣品放在燒杯中并不斷滴入稀鹽酸。當稀鹽酸滴加至35g時,燒杯內溶液的總質量為38.8g,(假設產生的氣體全部逸出),產生氣體的質量與滴入稀鹽酸的質量關系如圖所示。請計算:
20.純堿是一種重要的工業原料,鹽湖中的純堿常常會含有少量的氯化鈉(其它雜質忽略不計)。取6g純堿樣品放在燒杯中并不斷滴入稀鹽酸。當稀鹽酸滴加至35g時,燒杯內溶液的總質量為38.8g,(假設產生的氣體全部逸出),產生氣體的質量與滴入稀鹽酸的質量關系如圖所示。請計算:
(1)A點產生氣體的質量m是g。
(2)B點時,燒杯內溶液中的溶質是(寫化學式)。
(3)純堿樣品中碳酸鈉的質量分數。(精確到0.1%)組卷:96引用:3難度:0.4


