2021-2022學年河南省南陽一中高一(下)第一次月考化學試卷
發布:2025/1/4 6:0:2
一、選擇題(本題包括16小題,每題3分,共48分,每小題只有一個選項符合題意)
-
1.核內中子數為N的離子R2+,質量數為A,則n g它的氧化物中所含質子的物質的量為( )
A. (A-N+8)molnA+16B. (A-N+10)molnA+18C.(A-N+2)mol D. (A-N+8)molnA組卷:30引用:2難度:0.6 -
2.已知短周期元素的離子aA2+、bB+、cC3-、dD-都具有相同的電子層結構,則下列敘述正確的是( )
A.原子半徑 A>B>D>C B.原子序數 d>c>b>a C.離子半徑 C>D>B>A D.單質的還原性 A>B>D>C 組卷:93引用:191難度:0.9 -
3.下列離子方程式正確的是( )
A.SiO2放入HF酸溶液中 SiO2+4H++4F?═SiF4↑+2H2O B.硅酸與氫氧化鈉溶液反應 H2SiO3+OH-═SiO32-+H2O C.向Na2SiO3溶液中通入過量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- D.向K2O2中滴加水:2K2O2+2H2O═4K++4OH-+ O2↑ 組卷:11引用:1難度:0.7 -
4.已知X、Y是原子核電荷數不大于18的元素。X原子的最外層電子數為a,次外層電子數為a+2;Y原子的最外層電子數為b-5,次外層為b。判斷X、Y兩元素形成的化合物的化學式是( )
A.XY2 B.Y4X C.Y2X3 D.XY5 組卷:22引用:2難度:0.7 -
5.下列有關說法中正確的是( )
①硅是非金屬元素,它的單質是灰黑色有金屬光澤的固體,常用作集成電路
②二氧化硅晶體是由SiO2分子構成的,它的熔點高,硬度大
③水玻璃是硅酸鈉的水溶液,可用于生產黏合劑和防火劑
④透閃石的化學成分為Ca2Mg5Si8O22(OH)2寫成氧化物的形式為:5MgO?2CaO?8SiO2?H2O
⑤SiO2既能和NaOH反應,又能和HF反應,所以二氧化硅屬于兩性氧化物
⑥水晶、瑪瑙、高溫結構陶瓷、壓電陶瓷均為硅酸鹽產品
⑦CO2 與SiO2 均是酸性氧化物,溶于水均得到相應的酸
⑧因為CaCO3+SiO2CaSiO3+CO2↑,所以硅酸的酸性比碳酸強高溫A.①②⑥ B.⑤⑦⑧ C.①③ D.①③④ 組卷:31引用:2難度:0.6 -
6.根據表中部分短周期元素的原子半徑和主要化合價信息,判斷以下敘述正確的是( )
元素代號 L M Q R T 原子半徑/nm 0.154 0.118 0.099 0.102 0.073 主要化合價 +1 +3 +7、-1 +6、-2 -2 A.氫化物的沸點為:H2T<H2R B.L和Q形成的化合物中,兩種微粒最外層均達到8電子穩定結構 C.單質的還原性順序:L<M D.穩定簡單離子半徑的大小順序為:L>T>R 組卷:9引用:3難度:0.7 -
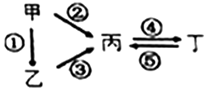 7.甲、乙、丙、丁均為中學化學常見的純凈物,它們之間有如圖所示的反應關系。下列物質組不滿足上述轉化關系的是( )
7.甲、乙、丙、丁均為中學化學常見的純凈物,它們之間有如圖所示的反應關系。下列物質組不滿足上述轉化關系的是( )選項 甲 乙 丙 丁 A Fe FeCl2 FeCl3 Fe(OH)3 B Si SiO2 Na2SiO3 H2SiO3 C Na Na2O Na2O2 NaOH D S H2S SO2 H2SO4 A.A B.B C.C D.D 組卷:2引用:1難度:0.7
二、非選擇題(本題共5題,共52分)
-
20.已知A、B、C、D 是元素周期表中的四種短周期元素,A 分別與B、C、D 化合形成三種化合物;甲、乙、丙。甲、乙、丙三種分子中含有相同數目的電子。丙與甲、乙均能發生化學反應,且甲、丙為無色有刺激性氣味的氣體,丁與C 的某種單質在常溫條件下反應生成紅棕色氣體;B、C、D三種元素的單質與甲、乙、丁三種化合物之間存在如圖所示的轉化關系:
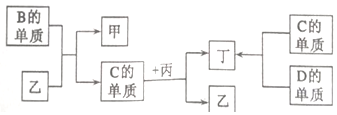
(1)元素D在元素周期表中的位置為。
(2)B、C、D 原子半徑由大到小順序為(用元素符號表示)。
(3)丁與C 的某種單質在常溫下反應生成紅棕色氣體的化學方程式為。
(4)甲、乙、丙分子中含有的電子數為。
(5)B 的單質+乙→甲+C 的單質的化學方程式為。組卷:102引用:2難度:0.1 -
21.為驗證鹵素單質氧化性的相對強弱,某小組用如圖所示裝置進行實驗(夾持儀器已略去,氣密性已檢驗)。
實驗過程: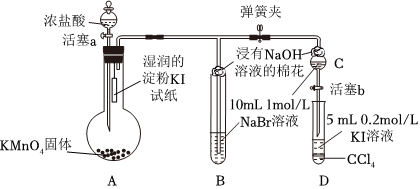
Ⅰ.打開彈簧夾,打開活塞a,滴加濃鹽酸。
Ⅱ.當B和C中的溶液都變為黃色時,夾緊彈簧夾。
Ⅲ.當B中溶液由黃色變為棕紅色時,關閉活塞a。
Ⅳ.(1)A中產生黃綠色氣體,該氣體的電子式是
(2)驗證氯氣的氧化性強于碘的實驗現象是
(3)B中溶液發生反應的離子方程式是
(4)為驗證溴的氧化性強于碘,過程Ⅳ的操作和現象是
(5)過程Ⅲ實驗的目的是
(6)氯、溴、碘單質的氧化性逐漸減弱的原因:同主族元素從上到下,得電子能力逐漸減弱。組卷:312引用:27難度:0.5


