2019-2020學年湖南省衡陽八中高一(下)開學考試化學試卷
發布:2024/12/26 7:30:2
一、單項選擇題(本題共20小題,每小題2分,共40分)
-
1.1999年1月,俄美科學家聯合小組宣布合成出114號元素的一種同位素,該同位素原子的質量數為298.以下敘述不正確的是( )
A.該元素屬于第七周期 B.該元素為金屬元素。性質與82Pb相似 C.該元素位于ⅢA族 D.該同位素原子含有114個電子,184個中子 組卷:18引用:12難度:0.7 -
2.用NA表示阿伏加德羅常數,下列敘述正確的是( )
A.標準狀況下,22.4L H2O含有的電子數為18NA B.1mol氦氣中含有NA個He原子數 C.通常狀況下,NA個CO2分子占有的體積為22.4L D.0.1mol/L (NH4)2SO4 溶液與 0.2mol/LNH4Cl溶液中的NH4+數目相同 組卷:22引用:1難度:0.6 -
3.實驗室里需用到480mL 0.1mol/L的硫酸銅溶液,以下配制溶液的操作正確的是( )
A.稱取7.6g硫酸銅,加入500 mL的水 B.稱取8.0g硫酸銅,配成500mL溶液 C.稱取12.0g膽礬,配成500mL溶液 D.稱取12.5g膽礬,加入500mL水 組卷:187引用:2難度:0.7 -
4.下列物質的鑒別方法不正確的是( )
A.利用丁達爾效應鑒別Fe(OH)3膠體與FeCl3溶液 B.用氫氧化鈉溶液鑒別MgCl2溶液、AlCl3溶液 C.用焰色反應鑒別NaCl、KCl和Na2SO4 D.用氯化鈣溶液鑒別Na2CO3和NaHCO3兩種溶液 組卷:24引用:7難度:0.9 -
5.對下列實驗的評價,正確的是( )
A.加入氯化鋇溶液有白色沉淀產生,再加鹽酸,沉淀不消失,一定有SO42- B.加入稀鹽酸產生無色氣體,將氣體通入澄清石灰水中,溶液變渾濁,一定有CO32- C.加入碳酸鈉溶液產生白色沉淀,再加鹽酸白色沉淀消失,一定有Ba2+ D.驗證燒堿溶液中是否含有Cl-,先加稍過量的稀硝酸除去OH-,再加入AgNO3溶液,如有白色沉淀,則證明有Cl- 組卷:69引用:10難度:0.7 -
6.下列實驗過程中產生沉淀的物質的量(Y) 與加入試劑的量(X)之間的關系正確的是( )
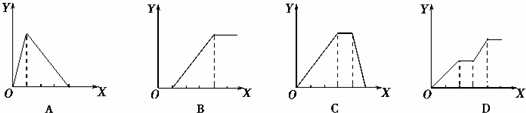
A.向AlCl3溶液中逐滴加入NaOH溶液至過量且邊滴邊振蕩 B.向NaAlO2溶液中滴加稀鹽酸至過量且邊滴邊振蕩 C.向NH4Al(SO4)2溶液中逐滴加入氫氧化鈉溶液直至過量 D.向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐漸通入二氧化碳至過量 組卷:532引用:23難度:0.9 -
7.已知金屬鈉的活潑性非常強,甚至在常溫時能和水發生反應2Na+2H2O═2NaOH+H2↑.現將9.2克鈉、7.2克鎂、8.1克鋁分別放入100克10.95%的鹽酸中,同溫同壓下產生氣體的質量比是( )
A.1:2:3 B.4:3:3 C.8:6:9 D.1:1:1 組卷:18引用:3難度:0.7 -
8.化學反應中會出現“一種物質過量,另一種物質仍不能完全反應”的特殊情況。下列反應中屬于這種情況的是( )
①過量稀硫酸與塊狀石灰石;
②過量的氫氣與氮氣催化劑存在下充分反應;
③過量稀硝酸與銅反應;
④常溫下將鋁片投入到過量濃硫酸中;
⑤過量銅與濃硫酸反應;
⑥過量的鋅與18mol/L 的硫酸反應;A.③④⑥ B.②③⑤ C.①②④⑤ D.①②③④⑤⑥ 組卷:52引用:6難度:0.7
二、非選擇題(每空2分,共58分)
-
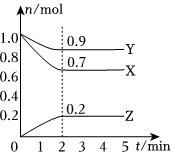 25.某溫度時,在2L的密閉容器中,X、Y、Z(均為氣體)三種物質的量隨時間的變化曲線如圖所示。
25.某溫度時,在2L的密閉容器中,X、Y、Z(均為氣體)三種物質的量隨時間的變化曲線如圖所示。
(1)由圖中所給數據進行分析,該反應的化學方程式為。
(2)若上述反應中X、Y、Z分別為H2、N2、NH3,某溫度下,在容積恒定為2.0L的密閉容器中充入2.0molN2和2.0molH2,一段時間后反應達平衡狀態,實驗數據如表所示:
0~50s內的平均反應速率 v(N2)=t/s 0 50 150 250 350 n(NH3) 0 0.24 0.36 0.40 0.40 ,250s時,H2的轉化率為。
(3)已知:鍵能指在標準狀況下,將1mol氣態分子AB(g)解離為氣態原子A(g),B(g)所需的能量,用符號E表示,單位為kJ/mol。N≡N的鍵能為946kJ/mol,H-H的鍵能為436kJ/mol,N-H的鍵能為391kJ/mol,則生成1molNH3過程中(填“吸收”或“放出”)的能量為kJ.反應達到(2)中的平衡狀態時,對應的能量變化的數值為kJ。
(4)t℃時,將2molSO2和1molO2通入體積為2L的恒溫恒容密閉容器中,發生如下反應:
2SO2(g)+O2(g)?2SO3(g),此反應放熱。2min時反應達到化學平衡,下列敘述能證明該反應已達到化學平衡狀態的是。
A.容器內壓強不再發生變化
B.SO2的體積分數不再發生變化
C.容器內氣體原子總數不再發生變化
D.相同時間內消耗2nmolSO2的同時消耗nmolO2
E.相同時間內消耗2nmolSO2 的同時生成nmolO2
F.混合氣體密度不再變化組卷:17引用:1難度:0.3 -
26.某興趣小組同學為探究黑木耳中含鐵量,進行如下實驗。
已知:i.黑木耳富含蛋白質、糖類、卵磷脂、鐵及一些還原性物質(如維生素C)等。每100克黑木耳含鐵高達185毫克。
ii.Fe2+與鐵氰化鉀(K3[Fe(CN)4])溶液反應生成藍色沉淀。
iii.紫色的KMnO4溶液在酸性條件下具有強氧化性,其還原產物是無色的Mn2+。
Ⅰ:為確定黑木耳中含有鐵元素,甲同學設計實驗方案如圖1。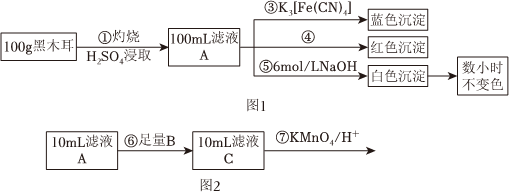
(1)步驟①用到儀器是;灼燒的目的是。
(2)步驟④檢驗Fe3+所用試劑是溶液。
(3)下列有關上述實驗得到的結論是(填字母序號)。
a.黑木耳中一定含Fe2+和Fe3+
b.濾液A中一定含Fe2+和Fe3+
c.白色沉淀中一定含Fe(OH)2
Ⅱ:為測定黑木耳中鐵元素的含量,乙同學設計實驗方案如圖2。
(4)可選作試劑B的物質是(填字母序號)。
a.Na b.Zn c.Fe d.Cu
(5)步驟⑦中觀察到的實驗現象是,反應的離子方程式是。
(6)若同學實驗操作規范,但測得含鐵量遠大于實際的含量,其可能的原因是。組卷:22引用:1難度:0.5


