2021年江蘇省連云港市高考化學演練試卷
發布:2024/4/20 14:35:0
一、選擇題(共10小題,滿分20分)
-
1.化學為人類的生產、生活提供了物質保證。下列工業生產原理不屬于化學變化的是( )
A.還原法冶煉生鐵 B.分餾法提煉汽油 C.接觸法制取硫酸 D.發酵法生產香醋 組卷:45引用:2難度:0.8 -
2.過氧化鈉常用作供氧劑:2Na2O2+2H2O═4NaOH+O2↑。下列說法錯誤的是( )
A.Na2O2的電子式: 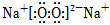
B.Na+的結構示意圖: 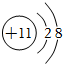
C.7.8g Na2O2中含有陰陽離子總數為0.4NA D.H2O的比例模型:  組卷:23引用:3難度:0.6
組卷:23引用:3難度:0.6 -
3.下列有關物質的性質與用途具有對應關系的是( )
A.FeCl3溶液顯酸性,可用于蝕刻印刷電路 B.氧化鋁硬度很大,可用于制造耐火材料 C.硝酸能發生酯化反應,可用于制造硝化甘油 D.濃H2SO4具有脫水性,可用于干燥氯氣 組卷:27引用:1難度:0.6 -
4.在給定條件下,下列選項中所示的物質間轉化均能一步實現的是( )
A.Al(OH)3 AlCl3(aq)鹽酸無水AlCl3蒸發B.Fe2O3 FeCl3(aq)鹽酸FeCuC.NaOH(aq) Cu(OH)2CuSO4(aq)Cu2O葡萄糖△D.NH3 NO2O2,△催化劑HNO3H2O組卷:71引用:3難度:0.7 -
5.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.水電離的c(H+)=1×10-13mol?L-1的溶液中:K+、Na+、AlO2-、CO32- B. =1×10-12的溶液中:K+、Na+、CO32-、NO3-c(H+)c(OH-)C.0.1mol?L-1KI溶液中:Na+、K+、ClO-、OH- D.能使酚酞變紅的溶液中:Na+、NH4+、SO42-、HCO3- 組卷:62引用:5難度:0.6 -
6.用下列實驗裝置進行相應實驗,能達到實驗目的的是( )
A. 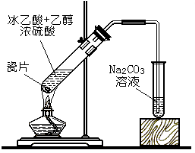
制備乙酸乙酯B. 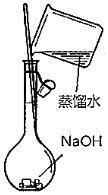
配制一定物質的量濃度的NaOH溶液C. 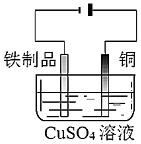
在鐵制品表面鍍銅D. 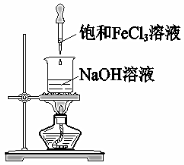
制備氫氧化鐵膠體組卷:23引用:1難度:0.5 -
7.下列表示對應化學反應的離子方程式正確的是( )
A.銅跟濃硝酸反應:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O B.向硫酸鋁溶液中加入過量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ C.向酸性KMnO4溶液中滴加H2O2:2MnO4-+7H2O2+6H+═2Mn2++6O2↑+10H2O D.同濃度同體積NH4HSO4溶液與NaOH溶液混合:NH4++OH-═NH3?H2O 組卷:52引用:1難度:0.7
三、填空題(共5小題,每小題10分,滿分56分)
-
20.一定條件下,通過下列反應可實現燃煤煙氣中硫的回收:2CO(g)+SO2(g)═2CO2(g)+S(l)△H
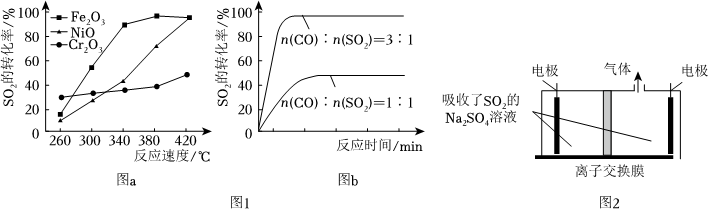
(1)已知:2CO(g)+O2(g)═2CO2(g)△H1=-566kJ/mol;S(l)+O2(g)═SO2(g)△H1=-296kJ/mol,則反應熱△H=kJ/mol。
(2)其他條件相同、催化劑不同時,SO2的轉化率隨反應溫度的變化如圖a所示。260℃時(填“Fe2O3”、“NiO”或“Cr2O3”)作催化劑反應速率最快。Fe2O3和NiO作催化劑均能使SO2的轉化率達到最高,不考慮價格因素,選擇Fe2O3的主要優點是。
(3)科研小組在380℃、Fe2O3作催化劑時,研究了不同投料比[n(CO):n(SO2)]對SO2轉化率的影響,結果如圖b所示。請分析當n(CO):n(SO2)=1:1時,SO2轉化率接近50%的原因。
(4)工業上還可用Na2SO3溶液吸收煙氣中的SO2:Na2SO3+SO2+H2O═2NaHSO3。某溫度下用1.0mol/L Na2SO3溶液吸收純凈的SO2,當溶液中c()降至0.2mol/L時,吸收能力顯著下降,應更換吸收劑。此時溶液中c(SO2-3)約為HSO-3mol/L,溶液的pH=。(已知該溫度下亞硫酸的平衡常數Ka1=1.75×10-2,Ka2=1.25×10-7)
(5)利用硫酸鈉溶液吸收SO2,再用惰性電極電解處理SO2。將陰極區溶液導出,經過濾分離出硫磺后,可循環吸收利用,裝置如圖2所示。
①該離子交換膜為。(填“陽離子交換膜”或“陰離子交換膜”)
②陰極的電極反應式為。組卷:51引用:2難度:0.4 -
21.某科研小組在900℃的空氣中合成出化學式為La2Ca2MnOx的超導體材料,其中La以+3價存在.為確定x的值,進行如下分析:
步驟1:準確稱取0.5250g超導體材料樣品,放入錐形瓶中,加25.00mL 0.06000mol?L-1Na2C2O4溶液(過量)和25mL 6mol?L-1HNO3溶液,在60-70℃下充分搖動,約半小時后得到無色透明溶液A(該條件下,只有Mn元素被還原為Mn2+,Na2C2O4被氧化為CO2).
步驟2:用0.02000mol?L-1KMnO4溶液滴定溶液A至終點,消耗10.00mL KMnO4溶液.
(1)步驟1反應后溶液中Mn2+的物質的量濃度為0.02000mol?L-1.常溫下,為防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范圍為[已知Mn(OH)2的Ksp=2.0×10-13].
(2)步驟2滴定終點的現象是.
(3)步驟2滴定終點讀數時俯視刻度,其他操作都正確,則所測x的值將(填“偏大”、“偏小”或“不變”).
(4)求x的值(寫出計算過程).組卷:125引用:4難度:0.5


