2021-2022學年北京市石景山區高三(上)期末化學試卷
發布:2024/4/20 14:35:0
一、本部分共14題,每題3分,共42分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.近幾年首鋼園成為北京文化創意產業的新高地。下列首鋼園中所涉及的材料不屬于金屬材料的是( )
A. 
首鋼園內的不銹鋼雕塑B. 
首鋼滑雪大跳臺的鋼結構賽道C. 
無人駕駛汽車的合金外殼D. 
觀賽區的塑料座椅組卷:15引用:1難度:0.6 -
2.2021年我國科學家首次合成新核素
U,下列說法不正確的是( )21492A. U原子核內質子數為21421492B. U原子核內中子數為12221492C. U原子核外電子數為9221492D. U和21492U互為同位素23592組卷:45引用:3難度:0.8 -
3.下列裝置用于實驗室制Cl2并回收MnCl2的實驗,能達到實驗目的的是( )

A.用裝置甲制取Cl2 B.用裝置乙除去Cl2中混有的少量HCl C.用裝置丙分離MnO2和MnCl2溶液 D.用裝置丁蒸干MnCl2溶液制得MnCl2?4H2O 組卷:34引用:2難度:0.5 -
4.下列性質的比較,不能用元素周期律解釋的是( )
A.酸性:H2SO3<HCl B.非金屬性:Cl>Br C.堿性:NaOH>Mg(OH)2 D.第一電離能:K<Ca 組卷:33引用:2難度:0.8 -
5.某小組同學驗證SO2的性質。裝置如下圖所示,培養皿中①、②、③三個塑料瓶蓋內盛有不同物質。向Na2SO3固體上滴加適量70%的H2SO4,迅速用玻璃片將培養皿蓋嚴,實驗記錄如下。下列說法不正確的是( )
實驗裝置 瓶蓋 物質 實驗現象 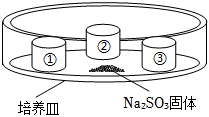
① 酸性KMnO4溶液 紫色褪去 ② 蘸有品紅溶液的棉花 紅色褪去 ③ 蒸餾水 無明顯變化 A.Na2SO3和H2SO4反應的化學方程式:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O B.瓶蓋①中的實驗現象能證明SO2具有還原性 C.瓶蓋②中的實驗現象能證明SO2具有漂白性 D.瓶蓋③中的實驗現象能證明SO2和水不反應 組卷:84引用:3難度:0.6 -
6.下列方程式與所給事實相符的是( )
A.向碳酸鈉溶液中滴入酚酞溶液,溶液變紅:CO32-+2H2O?H2CO3+2OH? B.Fe(OH)2白色沉淀在空氣中變為紅褐色:4Fe(OH)2+O2+2H2O═4Fe(OH)3 C.蒸餾水中加入碳酸鈣粉末導電能力增強:CaCO3?Ca2++CO32- D.鋼鐵發生吸氧腐蝕時,鐵做負極被氧化:Fe-3e-═Fe3+ 組卷:21引用:1難度:0.6
二、本部分共5題,共58分。
-
18.d區金屬元素鈦有“太空金屬”“未來金屬”等美譽,在航空航天、海洋產業等行業有重要作用。回答下列問題:

(1)基態鈦原子的核外電子排布式為。
(2)原子中運動的電子有兩種相反的自旋狀態,若一種自旋狀態用+表示,與之相反的則用-12表示,稱為電子的自旋磁量子數。對于基態鈦原子,其價電子自旋磁量子數的代數和為12。
(3)如圖1所示的晶體結構是一種基礎無機介電材料的最小結構單元(晶胞),這種晶體材料的化學式為。
(4)我國科學家用Mg3N2和TiCl4制備超導材料TiN,理論分析可能的反應為:
Mg3N2+2TiCl4═2TiN+3MgCl2+Cl2↑Ⅰ
4Mg3N2+6TiCl4═6TiN+12MgCl2+N2↑Ⅱ
已知:ⅰ.部分物質的熔沸點
ⅱ.TiCl4能和NaOH溶液反應。Mg3N2 TiCl4 MgCl2 TiN 熔點/℃ 800(分解) ?25 714 2950 沸點/℃ 700(升華) 136.4 1412 (略)
制備TiN的關鍵步驟如下:600℃時,將TiCl4按0.2L/min的速率通入盛有Mg3N2的剛玉坩堝內,當TiCl4適當過量后停止通入,在N2中冷卻至室溫。
科學家通過測定不同時間段尾氣處理裝置中鈦和氯的質量百分含量,進而確定生成TiN反應的化學方程式。
①TiCl4屬于晶體。
②結合圖,判斷制備TiN的反應是“Ⅰ”還是“Ⅱ”,并說明判斷依據。組卷:22引用:2難度:0.6 -
19.某小組通過實驗探究NO的某些性質。
(1)從氮元素的價態角度分析,NO有性。
(2)以Cu和HNO3為原料制備NO,反應的化學方程式為。
(3)設計實驗探究NO的氧化性。
實驗Ⅰ:用排水法收集一瓶NO,將其倒扣在盛有堿性Na2SO3溶液的水槽中,振蕩,觀察到集氣瓶中液面上升。
資料:ⅰ.NO與堿性Na2SO3溶液會發生氧化還原反應,NO被還原為N2O22-。
ⅱ.Ag+與N2O22-反應生成黃色沉淀。
①檢驗SO32-的氧化產物。取少量實驗Ⅰ反應后集氣瓶中的溶液,(填操作和實驗現象)。
②某同學認為,需通過進一步實驗驗證NO的氧化性,補充以下實驗:
實驗Ⅱ:取飽和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,無明顯變化。
實驗Ⅲ:取少量實驗Ⅰ反應后集氣瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,(填實驗現象)。
上述實驗證明NO有氧化性。
實驗Ⅱ的目的是。
③寫出NO與堿性Na2SO3溶液反應的離子方程式。
④從電極反應角度分析NO與堿性Na2SO3溶液的反應。
還原反應:2NO+2e-═N2O22-
氧化反應:。
實驗Ⅳ:用排水法收集兩瓶NO,將其分別倒扣在飽和Na2SO3溶液和加有NaOH的飽和Na2SO3溶液中,后者集氣瓶中液面上升更快。
根據上述實驗所得結論:。
(4)某同學結合所學知識設計處理工業廢氣中SO2和NO的實驗方案,達到消除污染,保護環境的目的。
①先用飽和純堿溶液吸收廢氣中的SO2,反應的化學方程式是。
②再向生成的溶液中加入一定量,以此溶液來吸收NO氣體。組卷:66引用:1難度:0.5


