2022-2023學年河北省邯鄲市雞澤一中高一(上)期中化學試卷(12月份)
發布:2024/9/28 8:0:1
一、選擇題:本題共10小題,每小題3分,共30分。在每小題列出的四個選項中,只有一項符合題目要求。
-
1.下列物質分類正確的組合是( )
選項 堿性氧化物 酸 堿 電解質 A 氧化鈣 H2CO3 純堿 氯化鈉 B 過氧化鈉 H2SO4 燒堿 硫酸銅 C 氧化銅 HNO3 氫氧化鎂 氧化鈉 D 氧化鈉 CH3COOH 氫氧化鋇 食鹽水 A.A B.B C.C D.D 組卷:33引用:2難度:0.8 -
2.下列有關化學用語表示正確的是( )
A.中子數為7的氮原子: 157NB.S2-的結構示意圖: 
C.NaHCO3在水中的電離方程式:NaHCO3═Na++H++ CO2-3D.小蘇打的化學式:Na2CO3 組卷:1引用:1難度:0.7 -
3.下列物質的性質與用途具有對應關系的是( )
A.二氧化氯具有強氧化性,可用來漂白織物 B.二氧化硫具有氧化性,可用于紙漿漂白 C.碳酸氫鈉能與堿反應,可用作食品膨松劑 D.Na2O2是淡黃色固體,在呼吸面具中用作供氧劑 組卷:7引用:4難度:0.6 -
4.下列指定反應的離子方程式正確的是( )
A.鈉與水反應:Na+2H2O═Na++2OH-+H2↑ B.向H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-═H2O C.濃鹽酸與MnO2反應制取Cl2:MnO2+2HCl(濃) Mn2++Cl2↑+H2O△D.Ca(HCO3)2溶液與少量NaOH溶液反應:HCO3-+Ca2++OH-═CaCO3↓+H2O 組卷:8引用:2難度:0.6 -
5.工業上常用濃氨水檢驗氯氣管道,其反應的化學方程式為3Cl2+8NH3═6NH4Cl+N2,利用該反應中產生白煙這一現象來判斷管道是否漏氣。下列關于該反應的說法錯誤的是( )
A.氧化劑是Cl2,N2是氧化產物 B.每生成22.4L的N2,轉移6mol電子 C.氧化劑與還原劑的物質的量之比為3:2 D.被氧化與未被氧化的NH3的物質的量之比為1:3 組卷:16引用:4難度:0.7 -
6.在給定的條件下,下列選項所示的物質間轉化均能實現的是( )
A.HClO Cl2光NaClONaOHB.S SO2O2BaSO3BaCl2(aq)C.Al AlCl3鹽酸NaAlO2氨水D.NaHCO3(s) Na2CO3(s)△NaOH(aq)澄清石灰水組卷:9引用:2難度:0.6
(二)非選擇題:本題共4大題,共50分。
-
18.某化學興趣小組同學利用以下裝置制取純凈、干燥的Cl2并探究Cl2及其化合物的漂白作用(Ⅳ中夾持裝置已略去,a為干燥的紅色紙條,b為濕潤的紅色紙條)。
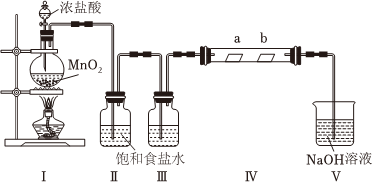
(1)裝置Ⅰ可用于制取Cl2,寫出該反應的化學方程式。
(2)裝置Ⅱ的作用是;裝置Ⅲ中的試劑名稱為。
(3)裝置Ⅳ中a處紅色紙條(填“無明顯變化”或“褪色”,下同),b處紅色紙條。
(4)裝置Ⅴ中NaOH溶液可吸收Cl2并制得漂白液,寫出該反應的離子方程式。
(5)為探究裝置Ⅴ中所得的漂白液的漂白效果和氧化性,某化學小組設計如下實驗。
查閱資料可知:
ⅰ.NaClO溶液具有氧化性,能使紫色石蕊試液先變藍后褪色;
ⅱ.溶液的pH會影響NaClO溶液的漂白效果。
具體實驗操作如下:
①漂白液的有效成分是NaClO而不是HClO,因為HClO不穩定,不易保存。寫出HClO見光分解的化學方程式實驗操作 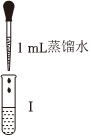
漂白液+石蕊試液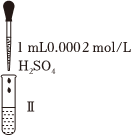
漂白液+石蕊試液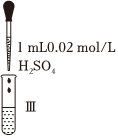
漂白液+石蕊試液實驗現象 混合后溶液的pH=9.9短時間內未褪色,一段時間后藍色褪去 混合后溶液pH=5.0,藍色迅速褪去,無氣體產生 混合后溶液pH=3.2,藍色迅速褪去,并產生大量氣體,使濕潤的淀粉-KI試紙變藍 。
②實驗Ⅲ中產生的氣體是Cl2,發生反應的離子方程式為。
③對比實驗Ⅱ和Ⅲ,溶液的pH(填“升高”或“降低”)會提高ClO-的氧化性。組卷:38引用:2難度:0.7 -
19.探究鈉及其化合物的性質,請按要求填空:
(1)Na、Na2O、Na2O2、NaOH久置空氣中最終都是變為。(填化學式)
(2)Na投入MgCl2溶液中發生反應的化學方程式有。
(3)常溫常壓下制取100mL純凈的CO2,將其通入裝有Na2O2粉末的兩通玻璃管中。
①反應的化學方程式為。
②若反應后收集的氣體體積為65mL,則反應消耗CO2的體積是mL。
(4)現有一種以NaHCO3為主要成分的膨松劑,由于膨松劑存放時間較長,部分分解成Na2CO3粉末。為測定混合樣品中NaHCO3的質量分數,按如圖所示連接裝置(裝置的氣密性良好,各裝置中的試劑皆為足量)。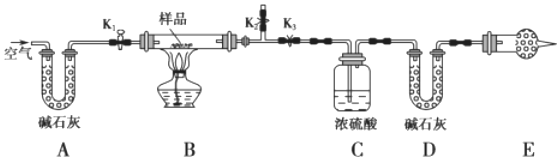
已知:堿石灰是固體氫氧化鈉和氧化鈣組成的混合物。
實驗過程:將樣品m1g裝入樣品管B,測定實驗前D的質量m2g:打開活塞K1、K2,關閉K3。緩緩鼓入空氣數分鐘,以除去裝置中的二氧化碳:然后關閉活塞K1、K2,打開K3,點燃酒精燈加熱至不再產生氣體。裝置B中發生反應的化學方程式為。
拆下裝置,再次稱量D的質量m3g。
①E處干燥管中盛放堿石灰的作用是。
②混合物中NaHCO3的質量分數為。(用含m1、m2、m3的代數式表示)組卷:134引用:2難度:0.7


