2023年江蘇省鎮江市丹陽市中考化學二模試卷
發布:2024/5/28 8:0:9
一、單項選擇題:共20題,每題2分,共40分。每題只有一個選項最符合題意。
-
1.下列屬于純凈物的是( )
A.水銀 B.蛋殼 C.石油 D.空氣 組卷:48引用:2難度:0.5 -
2.下列現象主要是由化學變化引起的是( )
A.冰川融化 B.酒精揮發 C.海水曬鹽 D.紅磷燃燒 組卷:45引用:2難度:0.5 -
3.下列物質的用途主要與化學性質有關的是( )
A.用金屬銀制作化妝鏡 B.用生石灰作食品干燥劑 C.用銅絲制作家用導線 D.用活性炭作冰箱除臭劑 組卷:73引用:4難度:0.6 -
4.下列做法符合“綠色、健康、安全、舒適”生活理念的是( )
A.植樹造林,防沙降塵 B.霉變花生,剝殼食用 C.高樓起火,電梯逃生 D.加高煙囪,消除污染 組卷:13引用:2難度:0.5 -
5.下列歸類不正確的是( )
選項 歸類 內容 A 營養物質 淀粉、油脂、蛋白質 B 無色溶液 雨水、白酒、蒸餾水 C 常見的堿 氨水、火堿、熟石灰 D 無機材料 鋁箔、陶瓷、碳素鋼 A.A B.B C.C D.D 組卷:23引用:2難度:0.5 -
6.分別配制NaOH溶液和稀硫酸并進行中和,下列實驗操作正確的是( )
A. 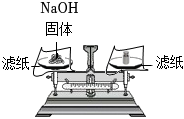
稱量B. 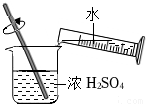
稀釋C. 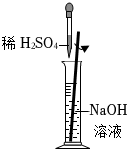
中和D. 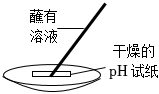
測pH組卷:26引用:2難度:0.8 -
7.下列實驗方法不正確的是( )
A.用煮沸法降低水的硬度 B.用稀鹽酸區分氧化銅和炭粉 C.用灼燒法鑒別羊毛線和棉紗線 D.用過量鐵粉除去FeCl3溶液中的少量HCl 組卷:12引用:2難度:0.7 -
8.下列排序不正確的是( )
A.空氣中氣體含量: 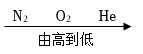
B.鎂元素質量分數: 
C.利用金屬的年代: 
D.物質的溶解性:  組卷:14引用:2難度:0.6
組卷:14引用:2難度:0.6 -
9.下列指定反應的化學方程式正確的是( )
A.木炭完全燃燒:2C+O2 2CO點燃B.證明鋁比銀活潑:A1+2AgNO3=Al(NO3)2+2Ag C.用Cu制取CuSO4:2Cu+O2+2H2SO4 O△2CuSO4+2H2D.聯合制堿法:NaCl+2NH3+CO2+H2O=2NH4Cl+NaHCO3↓ 組卷:34引用:2難度:0.6 -
10.某化肥廠生產丁(尿素)時有下列轉化。下列說法不正確的是( )
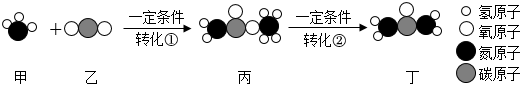
A.轉化①、②分別是化合反應、分解反應 B.整個過程中共有2種氧化物 C.整個轉化中,甲與丁的分子個數之比為2:1 D.丁為銨態氮肥,不能與草木灰混用 組卷:26引用:2難度:0.6
二、解答題
-
29.現有一包固體,可能含有Na2SO4、Fe(NO3)3、K2CO3、NaCl、KOH、BaCl2中的一種或幾種。現做如下實驗。
(1)取適量固體樣品于燒杯中,加入過量稀HNO3,無氣泡冒出,固體全部溶解,得到黃色溶液A.則原固體一定含,一定不含。
(2)向黃色溶液A中加入過量的試劑甲,產生白色固體,充分反應后過濾,得到濾液B。則原固體一定含Na2SO4,一定不含。
(3)向濾液B中加入適量AgNO3溶液,產生白色固體。則原固體一定含NaCl,試劑甲為溶液。
(4)為進一步確定該固體的組成,可采用的方法是。組卷:37引用:2難度:0.7 -
30.從古至今,鐵及其化合物一直被人類廣泛應用。
一、鐵及其化合物的應用
(1)如圖為商代鐵刃銅鉞,以隕鐵為刃、青銅為柄,說明此時人類已知道隕鐵硬度比青銅(選填“大”或“小”)。隕鐵部分腐蝕程度明顯大于青銅部分的原因是。
(2)中國古代煉鐵的方法:
鐵礦石生鐵1100~1200℃鋼鍛打熟鐵鍛打
①以赤鐵礦為原料冶煉鐵反應的化學方程式。
②熟鐵是含碳量在0.1%以下的鐵。生鐵經鍛打成為鋼、進而鍛打成為熟鐵,主要是降低元素含量。
(3)鐵的化合物在現代更多領域發揮著重要作用。
①鐵酸鋅(ZnFe2O4)可用于循環分解水制氫,其反應可表示為:
6ZnFe2O46ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O1200℃3ZnFe2O4+H2↑700℃
在此循環分解水制氫法中,鐵酸鋅的作用為。
②碳酸亞鐵(FeCO3)與砂糖混用可作補血劑。碳酸亞鐵在潮濕的空氣中轉化成氫氧化鐵和一種氣體,轉化的化學反應方程式為。
二、FeCO3的制備
用工業燒渣(含有Fe2O3、FeO和SiO2)制備FeCO3主要流程如下。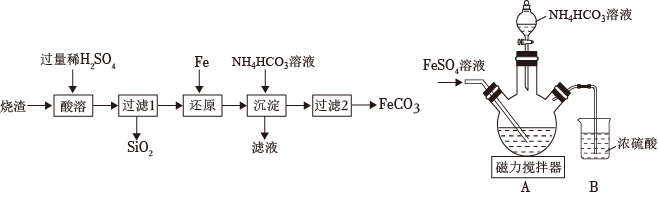
(4)燒渣研磨成粉末的目的是。
(5)還原發生的反應為Fe2(SO4)3+Fe=3FeSO4。
沉淀發生的反應為FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O。該反應可在如圖裝置中進行。
①反應時溫度不宜太高,原因是。
②下列說法正確的是(選填序號)。
a.組裝好裝置后檢查裝置氣密性
b.需先通氮氣排盡裝置內空氣
c.裝置B中濃硫酸的作用是防止空氣中水蒸氣進入
(6)流程中過濾2次,能否省略過濾1而只進行過濾2,請判斷并說明理由。
(7)過濾獲得FeCO3后需要洗滌等。判斷固體已經洗凈的方法:取最后一次洗滌后的濾液,滴加(填化學式)溶液,無現象。
三、FeCO3的含量測定
稱取含Fe(OH)3的FeCO3樣品180.2g,進行熱分解實驗。控制不同的溫度對樣品加熱,測得剩余固體質量隨溫度的變化如圖所示。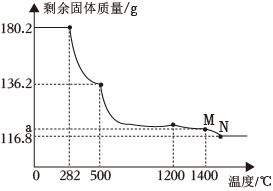
【資料】①在282℃時,FeCO3分解為FeO和CO2;在500℃時,Fe(OH)3分解為Fe2O3。
②鐵的氧化物加熱分解的溫度如下:
Fe2O3Fe3O41200℃FeO1400℃
(8)樣品中FeCO3的含量為%(精確到0.1%)。
(9)M點對應縱坐標的a=。
(10)N點對應固體為混合物,可用FexOy表示其組成,則x:y=。組卷:143引用:2難度:0.5


