《第1章 化學反應原理》2013年單元測試卷(建甌二中)
發布:2024/12/23 12:30:3
一、選擇題(本題包括16小題,每小題3分,共48分,每小題只有一個正確答案)
-
1.同一溫度下,強電解質溶液a、弱電解質溶液b、金屬導體c三者的導電能力相同,若升高溫度后,它們的導電能力強弱順序是( )
A.b>a>c B.a=b=c C.c>a>b D.b>c>a 組卷:228引用:7難度:0.7 -
2.氯氣溶于水達到平衡后,若其它條件不變,只改變某一條件,下列敘述正確的是( )
A.再通入少量氯氣,[H+]/[ClO-]減小 B.通入少量SO2,溶液漂白性增強 C.加入少量NaOH,一定有[Na+]=[Cl-]+[ClO-] D.加入少量水,水的電離平衡正反應方向移動 組卷:17引用:7難度:0.7 -
3.取濃度相同的NaOH和HCl溶液,以3:2體積比相混合,所得溶液的pH等于12,則該原溶液的濃度為( )
A.0.01mol?L-1 B.0.017mol?L-1 C.0.05mol?L-1 D.0.50mol?L-1 組卷:137引用:37難度:0.7 -
4.欲使0.1mol/L的KHCO3溶液[H+]、[CO32-]、[HCO3-]都減小,可采用的方法是( )
A.通入CO2氣體 B.加入NaOH固體 C.通入HCl氣體 D.加入飽和石灰水溶液 組卷:24引用:2難度:0.7 -
5.在一定體積pH=12的Ba(OH)2溶液中,逐滴加入一定物質的量濃度的NaHSO4溶液,當溶液中的Ba2+恰好完全沉淀時,溶液pH=11.若反應后溶液的體積等于Ba(OH)2溶液與NaHSO4溶液的體積之和,則Ba(OH)2溶液與NaHSO4溶液體積比是( )
A.1:9 B.1:1 C.1:2 D.1:4 組卷:194引用:56難度:0.7 -
6.在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-離子完全沉淀;如加入足量強堿并加熱可得到c mol NH3,(已知NH4++OH-
NH3↑+H2O)則原溶液中的Al3+的物質的量濃度(mol?L-1)為( )△A. 2b-c2aB. 2b-caC. 2b-c3aD. 2b-c6a組卷:123引用:105難度:0.7 -
7.下列離子方程式正確的是( )
A.用惰性電極電解飽和氯化鈉溶液:2Cl-+2H+ H2+Cl2通電B.氯氣通入濃氫氧化鈉溶液中加熱:3Cl2+6OH- △+5Cl-+3H2OClO-3C.用稀硝酸溶解FeS固體:FeS+2H+=Fe2++H2S D.硫酸氫鈉溶液與足量氫氧化鋇溶液混合:2H++ +Ba2++2OH-=BaSO4+2H2OSO2-4組卷:15引用:1難度:0.7
二、非選擇題(17題9分、18題10分、19題9分、20題10分、21題14分、共52分.)
-
20.在25mL 0.1mol?L-1的NaOH溶液中逐滴加入0.2mol?L-1的CH3COOH溶液,溶液pH變化曲線如圖1所示.
(1)B點溶液呈中性,有人據此認為,在B點時NaOH溶液與CH3COOH溶液恰好完全反應,這種看法是否正確?(填“是”或“否”),如果不正確,則二者恰好完全反應的點是在(填“AB”、“BC”或“CD”)區間內.
(2)關于該滴定實驗,從下列選項中選出最恰當的一項(選用滴定管如圖2所示).
(3)的D點時,溶液中c(CH3COO-)+c(CH3COOH)錐形瓶中的溶液 滴定管中的溶液 選用指示劑 選用滴定管 A 堿 酸 石蕊 乙 B 酸 堿 甲基橙 甲 C 堿 酸 酚酞 甲 D 酸 堿 酚酞 乙 2c(Na+)(填“>”、“<”或“=”).
(4)在C點,溶液中離子濃度由大到小的順序為:.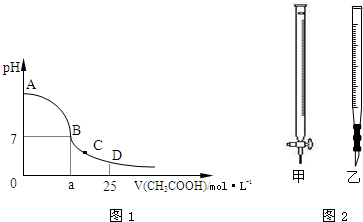 組卷:14引用:3難度:0.3
組卷:14引用:3難度:0.3 -
21.有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Cl-、I-、NO3-、CO32-、S2-、SO42-、AlO2-、SO32-,取該溶液進行以下實驗:
(1)取pH試紙檢驗,溶液呈強酸性,可以排除離子的存在.
(2)取出部分溶液,加入少量CCl4及數滴新制氯水,經振蕩后CCl4層呈紫紅色,可以排除離子的存在.
(3)另取出部分溶液逐漸加入NaOH溶液,使溶液從酸性逐漸變為堿性,在滴加過程中和滴加完畢后,溶液均無沉淀產生,則又可以排除離子的存在.
(4)取出部分上述堿性溶液加Na2CO3溶液后,有白色沉淀生成.
(5)將(3)得到的堿性溶液加熱,有氣體放出,該氣體能使濕潤的紅色石蕊試紙變藍.
根據上述實驗事實確定:該溶液中肯定存在的離子是,還不能確定是否存在的離子是.組卷:40引用:5難度:0.5


