2018-2019學(xué)年福建省龍巖市上杭二中高二(上)開(kāi)學(xué)化學(xué)試卷
發(fā)布:2024/11/25 4:0:2
一、單項(xiàng)選擇題(本題共18道小題,每小題3分,共54分)
-
1.下列與化學(xué)反應(yīng)能量變化相關(guān)的敘述正確的是( )
A.生成物總能量一定低于反應(yīng)物總能量 B.放熱反應(yīng)的反應(yīng)速率總是大于吸熱反應(yīng)的反應(yīng)速率 C.應(yīng)用蓋斯定律,可計(jì)算某些難以直接測(cè)量的反應(yīng)焓變 D.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點(diǎn)燃條件下的△H不同 組卷:1192引用:169難度:0.9 -
2.以惰性電極電解下列物質(zhì)的水溶液(電解質(zhì)均過(guò)量),電解后溶液pH升高的是( )
A.硫酸 B.氫氧化鉀 C.硝酸銀 D.硫酸鈉 組卷:13引用:6難度:0.7 -
3.下列說(shuō)法正確的是( )
A.等質(zhì)量的硫蒸氣和硫固體分別完全燃燒,后者放出的熱量多 B.由C(金剛石)→C(石墨)△H=-1.9KJ/mol 可知,金剛石比石墨穩(wěn)定 C.在101Kpa時(shí),2gH2完全燃燒生成液態(tài)水,放出285.8KJ熱量,氫氣燃燒的熱化學(xué)方程式為:2H2(g)+O2(g)=2H2O(l)△H=+285.8KJ/mol D.稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-53.7KJ/mol,若將含1 mol CH3COOH與含1 mol NaOH的溶液混合,放出的熱量小于53.7KJ 組卷:14引用:2難度:0.9 -
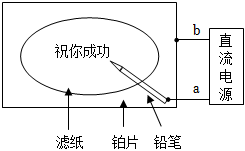 4.某學(xué)生設(shè)計(jì)了一個(gè)“黑筆寫(xiě)紅字”的趣味實(shí)驗(yàn)。濾紙先用氯化鈉、無(wú)色酚酞的混合液浸濕,然后平鋪在一塊鉑片上,接通電源后,用鉛筆在濾紙上寫(xiě)字,會(huì)出現(xiàn)紅色字跡。據(jù)此,下列敘述正確的是( )
4.某學(xué)生設(shè)計(jì)了一個(gè)“黑筆寫(xiě)紅字”的趣味實(shí)驗(yàn)。濾紙先用氯化鈉、無(wú)色酚酞的混合液浸濕,然后平鋪在一塊鉑片上,接通電源后,用鉛筆在濾紙上寫(xiě)字,會(huì)出現(xiàn)紅色字跡。據(jù)此,下列敘述正確的是( )A.鉛筆端作陽(yáng)極,發(fā)生還原反應(yīng) B.鉑片端作陰極,發(fā)生氧化反應(yīng) C.鉛筆端有少量的氯氣產(chǎn)生 D.a(chǎn)點(diǎn)是負(fù)極,b點(diǎn)是正極 組卷:160引用:60難度:0.9 -
5.已知熱化學(xué)方程式:SO2(g)+
O2(g)?SO3(g)△H=-98.32kJ/mol,在容器中充入2mol SO2和1mol O2充分反應(yīng),最終放出的熱量為( )12A.196.64kJ B.196.64kJ/mol C.<196.64kJ D.>196.64kJ 組卷:73引用:50難度:0.9 -
6.在電解水制取H2和O2時(shí),為了增強(qiáng)溶液的導(dǎo)電性,常加入一些電解質(zhì).下列物質(zhì)中最合適的是( )
A.NaCl B.CuCl2 C.Na2SO4 D.AgNO3 組卷:18引用:17難度:0.9 -
7.關(guān)于如圖所示裝置的判斷,敘述正確的是( )
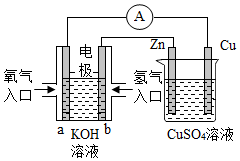
A.左邊的裝置是電解池,右邊的裝置是原電池 B.該裝置中銅為正極,鋅為負(fù)極 C.當(dāng)銅片的質(zhì)量變化為12.8 g時(shí),a極上消耗的O2在標(biāo)準(zhǔn)狀況下的體積為2.24 L D.裝置中電子的流向是:a→Cu→經(jīng)過(guò)CuSO4溶液→Zn→b 組卷:116引用:17難度:0.7
二、填空題(本題共4道小題,共46分)
-
21.Zn-MnO2干電池應(yīng)用廣泛,其電解質(zhì)溶液是ZnCl2-NH4Cl混合溶液。
(1)該電池的負(fù)極材料是。電池工作時(shí),電子流向(填“正極”或“負(fù)極”)。
(2)若ZnCl2-NH4Cl混合溶液中含有雜質(zhì)Cu2+,會(huì)加速某電極的腐蝕。其主要原因是。欲除去Cu2+,最好選用下列試劑中的(填代號(hào))。
a.NaOH b.Zn c.Fe d.NH3?H2O
(3)MnO2的生產(chǎn)方法之一是以石墨為電極,電解酸化的MnSO4溶液。陰極的電極反應(yīng)式是:。若電解電路中通過(guò)2mol電子,MnO2的理論產(chǎn)量為。組卷:943引用:25難度:0.5 -
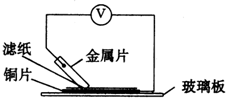 22.將潔凈的金屬片A、B、C、D分別放置在浸有鹽溶液的濾紙上面并壓緊(如圖所示).在每次實(shí)驗(yàn)時(shí),記錄圖中電壓表指針的移動(dòng)方向和電壓表的讀數(shù)如下:
22.將潔凈的金屬片A、B、C、D分別放置在浸有鹽溶液的濾紙上面并壓緊(如圖所示).在每次實(shí)驗(yàn)時(shí),記錄圖中電壓表指針的移動(dòng)方向和電壓表的讀數(shù)如下:
已知構(gòu)成兩電極的金屬其金屬活潑性相差越大,電壓表的讀數(shù)越大.請(qǐng)根據(jù)表中數(shù)據(jù)回答下列問(wèn)題.金屬 電子流動(dòng)方向 電壓/V A A→Cu +0.78 B Cu→B -0.15 C C→Cu +1.35 D D→Cu +0.30
(1)金屬可能是最強(qiáng)的還原劑;金屬一定不能從硫酸銅溶液中置換出銅.
(2)若濾紙不用鹽溶液浸潤(rùn)而改用NaOH溶液浸潤(rùn),則在濾紙上能看到有藍(lán)色沉淀析出的金屬是(填字母).其對(duì)應(yīng)電池的電極反應(yīng)式為:負(fù)極:;正極:.組卷:16引用:2難度:0.5


