2019-2020學年四川省成都市蒲江中學高二(上)期中化學試卷
發布:2024/11/5 22:0:2
一、選擇題。本題共20小題,每小題只有一個選項符合題意,每小題2分,共40分。
-
1.環境污染問題越來越受到人們的關注,造成環境污染的主要原因大多是由于人類生產活動中過度排放有關物質引起的.下列環境問題與所對應的物質不相關的是( )
A.溫室效應--二氧化碳 B.光化學污染--二氧化氮 C.酸雨--二氧化碳 D.白色污染--一次性塑料制品的使用 組卷:27引用:7難度:0.9 -
2.用化學用語表示NH3+HCl═NH4Cl中的相關微粒,其中正確的是( )
A.中子數為8的氮原子: N87B.HCl的電子式: 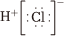
C.NH3的結構式: 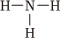
D.Cl-的結構示意圖: 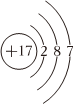 組卷:1142引用:31難度:0.9
組卷:1142引用:31難度:0.9 -
3.下表物質與其所含化學鍵類型、所屬化合物類型完全正確的一組是( )
選項 A B C D 物質 CO2 MgCl2 NH4Cl NaOH 所含化學鍵類型 共價鍵 離子鍵、共價鍵 離子鍵 離子鍵、共價鍵 所屬化合物類型 共價化合物 離子化合物 離子化合物 共價化合物 A.A B.B C.C D.D 組卷:8引用:2難度:0.7 -
4.設NA為阿伏加德羅常數,下列敘述中正確的是( )
A.46g NO2和N2O4混合氣體中含有原子數為3NA B.標準狀況下22.4L SO3中含原子數為4NA C.1L 1mol?L-1醋酸(CH3COOH)溶液中氫離子總數為NA D.1mol Fe與足量Cl2反應失去2NA個電子 組卷:2引用:1難度:0.8 -
5.下列反應中,屬于加成反應的是( )
A.將苯滴入溴水中,振蕩后水層接近無色 B.乙烯使酸性KMnO4溶液褪色 C.甲烷與氯氣混合,光照后黃綠色變淺 D.乙烯使溴的四氯化碳溶液褪色 組卷:21引用:3難度:0.9 -
6.用下列實驗裝置完成對應的實驗(部分儀器已省略),能達到實驗目的的是( )
A. 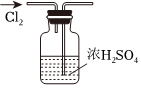
干燥Cl2B. 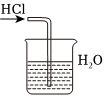
吸收HClC. 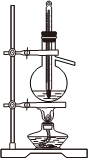
石油的蒸餾D. 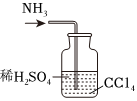
吸收NH3組卷:52引用:8難度:0.7 -
7.下列實驗方案合理的是( )
A.配制50g質量分數為5%NaCl溶液:將45mL水加入到盛有5g NaCl的燒杯中,攪拌溶解 B. 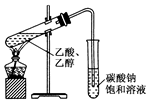
制備乙酸乙酯:用如圖所示的實驗裝置C.鑒定 :向溶液中加入鹽酸酸化的氯化鋇溶液SO2-4D.鑒別環己烯和苯:將溴的四氯化碳溶液分別滴加到少量環己烯和苯中 組卷:4引用:3難度:0.5 -
8.短周期主族元素X、Y、Z、W原子序數依次增大,X是地殼中含量最多的元素,Y原子的最外層只有一個電子,Z位于元素周期表ⅢA族,W與X屬于同一主族。下列說法正確的是( )
A.原子半徑:r(W)>r(Z)>r(Y) B.由X、Y組成的化合物中均不含共價鍵 C.Y的最高價氧化物的水化物的堿性比Z的弱 D.X的簡單氣態氫化物的熱穩定性比W的強 組卷:1138引用:38難度:0.7
二、非選擇題本題共5小題,共60分,請按要求將答案填寫在相應的空格里。
-
 24.某實驗小組以H2O2分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響。在常溫下按照如下方案完成實驗。
24.某實驗小組以H2O2分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響。在常溫下按照如下方案完成實驗。
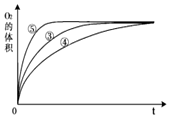
(1)催化劑能加快化學反應速率的原因是分組實驗 催化劑 ① 10mL 5% H2O2溶液 無 ② 10mL 2% H2O2溶液 無 ③ 10mL 5% H2O2溶液 1mL 0.1mol?L-1FeCl3溶液 ④ 10mL 5%H2O2溶液+少量HCl溶液 1mL 0.1mol?L-1FeCl3溶液 ⑤ 10mL 5% H2O2溶液+少量NaOH溶液 1mL 0.1mol?L-1FeCl3溶液 。
(2)實驗①和②的目的是。實驗時由于沒有觀察到明顯現象而無法得出結論。資料顯示,通常條件下H2O2穩定,不易分解。為了達到實驗目的,你對原實驗方案的改進是。
(3)實驗③、④、⑤中,測得生成氧氣的體積隨時間變化的關系如圖。 分析上圖能夠得出的實驗結論是。
(4)為確定MnO2催化雙氧水分解的最佳條件,用該實驗裝置進行實驗,反應物用量和反應停止的時間數據如表。
分析表中數據回答下列問題:
0.1g 0.3g 0.8g 10mL 1.5% 223s 67s 36s 10mL 3.0% 308s 109s 98s 10mL 4.5% 395s 149s 116s
①相同濃度的過氧化氫的分解速率隨著MnO2用量的增加而(填“加快”、“減慢”或“不變”)。
②從實驗效果和“綠色化學”的角度考慮,雙氧水的濃度相同時,加入g的MnO2為較佳選擇。
③該小組的某同學分析上述數據后認為:“當用相同質量的MnO2時,雙氧水的濃度越小,所需要的時間就越少,亦即其反應速率越快”的結論,你認為是否正確?(填“正確”或“不正確”),理由是。組卷:11引用:2難度:0.4 -
25.(1)工業制取氫氣的一個反應為:CO+H2O(g)?CO2+H2.在T℃時,往1L密閉容器中充入0.2mol CO和0.3mol水蒸氣,反應達平衡后,體系中c(H2)═0.12mol?L-1.該溫度下此反應的平衡常數K=
(填計算結果);
(2)若在恒溫恒容的容器內進行反應CO(g)+2H2 (g)?CH3OH(g),在密閉容器中開始只加入CO、H2,反應10min后測得各組分的濃度如下:
①該時間段內反應速率v(H2)=物質 H2 CO CH3OH 濃度/(mol?L-1) 0.20 0.10 0.40 ;
②該反應達到平衡狀態的標志是(填字母序號);
A.有1個H-H鍵生成的同時有3個C-H鍵生成
B.CO的百分含量保持不變
C.容器中混合氣體的壓強不變化
D.容器中混合氣體的密度不變化
(3)已知NO2和N2O4可以相互轉化:2NO2(g)?N2O4(g)△H<0。現將一定量NO2和N2O4的混合氣體通入一體積為1L的恒溫密閉容器中,反應物濃度隨時間變化關系如圖所示,回答下列問題: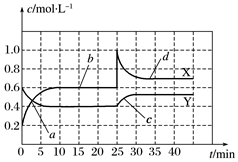
①圖中共有兩條曲線X和Y,其中曲線表示NO2濃度隨時間的變化;a、b、c、d四個點中,表示化學反應處于平衡狀態的點是。
②反應進行至25min時,曲線發生變化的原因是。
③若要使平衡時體系中NO2的體積分數與d點時NO2體積分數相同,在25min時還可以采取的措施是。
A.加入催化劑
B.縮小容器體積
C.升高溫度
D.加入一定量的N2O4組卷:5引用:1難度:0.5


