2021-2022學年江西省撫州市崇仁二中高二(上)第一次月考化學試卷
發布:2024/11/30 1:0:2
一、單項選擇題(每題3分、共計48分)
-
1.全球變暖、地球正面臨巨大挑戰。下列說法不正確的是( )
A.推廣“低碳經濟”,減少溫室氣體的排放 B.將煤轉化成氣體燃料可以有效地減少“溫室效應”的氣體產生 C.推廣“綠色汽油”計劃,吸收空氣中的CO2并利用廉價能源合成汽油 D.加快太陽能、風能、生物質能、海洋能等清潔能源的開發利用 組卷:12引用:1難度:0.6 -
 2.分析圖中的能量變化情況,下列正確的( )
2.分析圖中的能量變化情況,下列正確的( )A.2A+B═2C ΔH<0 B.2C═2A+B ΔH<0 C.2A(g)+B(g)═2C(g) ΔH<0 D.2A(g)+B(g)═2C(g) ΔH>0 組卷:18引用:3難度:0.7 -
3.在298K、100kPa時,已知:
2H2O(g)═2H2(g)+O2(g)△H1
H2(g)+Cl2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
則△H3與△H1和△H2間的關系正確的是( )A.△H3=△H1+2△H2 B.△H3=△H1+△H2 C.△H3=△H1-2△H2 D.△H3=△H1-△H2 組卷:992引用:172難度:0.7 -
4.根據以下3個熱化學方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)ΔH=-Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=-Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)ΔH=-Q3kJ/mol
判斷Q1、Q2、Q3三者關系正確的是( )A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3 組卷:837引用:174難度:0.5 -
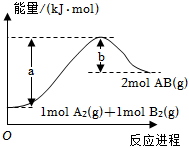 5.已知化學反應A2(g)+B2(g)═2AB(g)的能量變化如圖所示,判斷下列敘述中正確的是( )
5.已知化學反應A2(g)+B2(g)═2AB(g)的能量變化如圖所示,判斷下列敘述中正確的是( )A.每生成2分子AB吸收bkJ熱量 B.該反應熱△H=+(a-b)kJ?mol-1 C.該反應中反應物的總能量高于生成物的總能量 D.斷裂1molA-A鍵和1molB-B鍵,放出akJ能量 組卷:376引用:44難度:0.9 -
6.已知 25℃、101kPa條件下:
4Al(s)+3O2(g)=2Al2O3,△H=-2834.9kJ?mol-1
4Al(s)+2O2(g)=2Al2O3,△H=-3119.1gkJ?mol-1
由此得出的正確結論是( )A.等質量的O2比O3的能量低,由O2變O3為放熱反應 B.等質量的O2比O3的能量低,由O2變O3為吸熱反應 C.O3比O2穩定,由O2變O3為放熱反應 D.O2比O3穩定,由O2變O3為吸熱反應 組卷:76引用:21難度:0.7 -
7.已知化學反應:C(s)+
O2(g)═CO(g)△H1<012
CO(g)+O2(g)═CO2(g)△H2<012
C(s)+O2(g)═CO2(g)△H3<0;
下列說法不正確的是(相同條件下)( )A.56g CO和32g O2所具有的總能量大于88g CO2所具有的總能量 B.12gC所具有的能量一定大于28gCO所具有的能量 C.△H1+△H2=△H3 D.將兩份質量相等的碳燃燒,生成CO2的反應比生成CO的反應放出的熱量多 組卷:35引用:4難度:0.7
二、非選擇題(每空2分、共計52分)
-
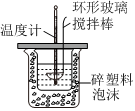 20.某實驗小組用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液進行中和熱的測定.
20.某實驗小組用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液進行中和熱的測定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若實驗中大約要使用245mL NaOH溶液,至少需要稱量NaOH固體g
Ⅱ.測定稀硫酸和稀氫氧化鈉中和熱的實驗裝置如圖所示.
(1)寫出該反應的熱化學方程式(中和熱為57.3kJ/mol):.
(2)取50mL NaOH溶液和30mL硫酸溶液進行實驗,實驗數據如表.
①請填寫表中的空白:
②近似認為0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比熱容c=4.18J/(g?℃).則中和熱ΔH=
溫度
實驗次數起始溫度t1/℃ 終止溫度
t2/℃溫度差平均值
(t2-t1)/℃H2SO4 NaOH 平均值 1 26.2 26.0 26.1 30.1 2 27.0 27.4 27.2 33.3 3 25.9 25.9 25.9 29.8 4 26.4 26.2 26.3 30.4 (取小數點后一位).
③上述實驗數值結果與57.3kJ/mol有偏差,產生偏差的原因可能是(填字母).
a.實驗裝置保溫、隔熱效果差 b.量取NaOH溶液的體積時仰視讀數
c.分多次把NaOH溶液倒入盛有硫酸的小燒杯中
d.用溫度計測定NaOH溶液起始溫度后直接測定H2SO4溶液的溫度.組卷:25引用:4難度:0.3 -
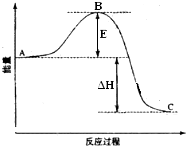 21.2SO2(g)+O2(g)=2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ?mol-1.請回答下列問題:
21.2SO2(g)+O2(g)=2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ?mol-1.請回答下列問題:
(1)圖中A、C分別表示、,E的大小對該反應的反應熱(填“有”或“無”)影響.該反應通常用V2O5作催化劑,加V2O5會使圖中B點(填“升高”還是“降低”),△H(填“變大”、“變小”或“不變”).
(2)圖中△H=KJ?mol-1;
(3)V2O5的催化循環機理可能為:V2O5氧化SO2時,自身被還原為四價釩化合物;四價釩化合物再被氧氣氧化為V2O5.寫出該催化循環機理的化學方程式、.組卷:14引用:2難度:0.5


