2021-2022學年河南省商丘一高高一(下)開學化學試卷
發布:2024/11/25 20:30:1
一、選擇題:(共54分,每小題只有一個選項正確)
-
1.化學與社會、生活、科技密不可分,下列說法正確的是( )
A.黑火藥的使用不涉及化學變化 B.神舟十三號載人飛船外殼使用的鋁合金屬于純凈物 C.指南針所用的磁性材料為Fe2O3 D.大氣層中的O3與空氣中的O2互為同素異形體 組卷:2引用:1難度:0.8 -
2.正確掌握化學用語是學好化學的基礎。下列化學用語正確的是( )
A.次氯酸的結構式:H-Cl-O B.氯離子的結構示意圖: 
C.二氧化碳的空間構型為直線型 D.硫化氫分子的電子式:  組卷:1引用:2難度:0.6
組卷:1引用:2難度:0.6 -
3.下列敘述正確的是(NA表示阿伏加德羅常數的值)( )
A.標準狀況下22.4LCCl4中含有4NA個共用電子對 B.1mol/LHF溶液中,HF分子數小于NA個 C.20gNa2O和Na2O2的混合物中,所含的陰、陽離子數目之比無法確定 D.1 O2與足量水充分反應,最終水溶液中含有NA個18OmolNa182組卷:3引用:1難度:0.8 -
4.SCR法(選擇性催化還原技術)是一種以NH3作為還原劑,將煙氣中NOx分解成無害的N2和H2O的干法脫硝技術,反應原理為:
①6NO+4NH3=5N2+6H2O;
②6NO2+8NH3=7N2+12H2O;
③NO+NO2+2NH3=2N2+3H2O,
下列說法正確的是( )A.NO2為酸性氧化物 B.反應①中氧化劑與還原劑的物質的量之比為2:3 C.反應②中氧化產物與還原產物的質量之比為4:3 D.反應③中每生成22.4 L N2,轉移電子數3NA 組卷:6引用:2難度:0.6 -
5.依據已知信息,由元素的原子結構和元素在周期表的位置,下列對堿金屬元素性質的預測或推理不合理的是( )
編號 已知信息 預測(推理) A 鈉在空氣中燃燒生成Na2O2 鋰在空氣中燃燒生成Li2O2 B 鈉可以跟冷水反應 其它堿金屬可以跟冷水反應 C NaOH是強堿 CsOH是更強的堿 D 鈉在自然界中以化合態存在 Rb在自然界中以化合態存在 A.A B.B C.C D.D 組卷:84引用:3難度:0.7 -
6.下列各組離子在指定溶液中能大量共存的是( )
A.c(Fe3+)=1mol?L-1的溶液中:K+、Mg2+、SCN-、Cl- B.澄清透明的溶液中:Cu2+、K+、 、Cl-SO2-4C.能溶解Al2O3的溶液中Na+、Fe2+、 、HCO-3SO2-4D.pH=2的溶液中:Na+、Ca2+、Cl-、 AlO-2組卷:2引用:1難度:0.5 -
7.下列離子方程式書寫正確的是( )
A.過量的CO2通入NaOH溶液:CO2+2OH-= +H2OCO2-3B.AlCl3溶液與過量的NaOH混合:Al3++3OH-=Al(OH)3 C.FeI2溶液中通入少量Cl2:Cl2+2Fe2+=2Fe3++2Cl- D.濃度相同、體積相同的NaHSO4溶液和Ba(OH)2溶液充分反應:Ba2++OH-+H++ =BaSO4↓+H2OSO2-4組卷:6引用:1難度:0.5
二、填空題(本題包括4小題,共46分)
-
21.氯元素形成的單質及其化合物有廣泛的應用。請回答下列問題:
Ⅰ.配制80mL0.2mol?L-1FeCl3溶液
(1)配制該溶液時所需玻璃儀器除燒杯、玻璃棒、膠頭滴管、量筒外,還需。
(2)使用托盤天平稱量FeCl3的質量為g。
(3)定容時,若仰視容量瓶刻度線會使配制的FeCl3溶液濃度(填“偏大”“偏小”或“不變”)。
Ⅱ.制備三氯化硼
已知:BCl3沸點12.5℃,熔點-107.3℃,易潮解;
(4)裝置A中制取Cl2的化學反應方程式為。
(5)裝置B的作用除了除去HCl氣體外還有(填標號)。
a.除去Cl2
b.判斷氣流速率
c.降低氣體溫度
d.作安全瓶
(6)因裝置D中是采用玻璃管盛裝硼粉加熱,則在E中收集的BCl3中常含有SiCl4(熔點為:-70℃,沸點為57.6℃)雜質,可采用方法提純BCl3。
(7)F中盛裝的試劑為(填名稱),其作用是。組卷:4引用:2難度:0.5 -
22.某廢舊金屬材料中主要含Fe、Cu、Al、FeO、Al2O3、CuO(其余成分與酸堿都不反應)和可燃性有機物,為節約和充分利用資源,通過如土工藝流程回收Al、Cu、綠礬等。
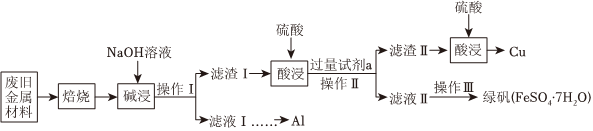
回答下列問題:
(1)“焙燒”的目的主要是將金屬單質轉化為氧化物,并除去。
(2)操作Ⅰ、Ⅱ中使用的儀器除燒杯、玻璃棒外還需要的玻璃儀器是。
(3)綠礬在空氣中容易被部分氧化為硫酸鐵,現取被部分氧化為硫酸鐵的晶體8.22g溶于稀鹽酸后,加入足量的BaCl2溶液,過濾得沉淀9.32g;再通入112mL(標準狀況)氯氣恰好將其中的Fe2+完全氧化。
①為確定綠礬未被全部氧化,可選擇的最佳試劑是(填標號)。
A.氯水
B.KSCN溶液
C.NaOH溶液
D.KMnO4酸性溶液
②推測晶體的化學式為[寫成xFeSO4?yFe2(SO4)3?zH2O的形式]。組卷:0引用:1難度:0.6


