2023-2024學年浙江省杭州市之江實驗中學九年級(上)月考科學試卷(10月份)
發布:2024/9/19 1:0:9
一、選擇題(本題共20小題,每題3分,共60分)
-
1.下列實驗操作規范的是( )
A. 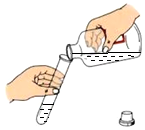
取適量液體B. 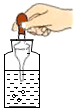
取液體時擠入空氣C. 
兩人合作滴加液體D. 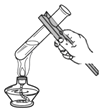
手按短柄加熱液體組卷:55引用:11難度:0.5 -
2.下列選項中可以確定某物質屬于堿的是( )
A.能使酚酞試液變紅色 B.能使紫色石蕊試液變藍色 C.電離時生成的陰離子全部是氫氧根離子 D.能跟酸發生反應生成鹽和水 組卷:6引用:2難度:0.5 -
3.為了維持人體正常的生命活動,人體不同器官內的體液具有不同的酸堿性,根據下表可知,在正常情況下( )
體液 尿液 胃液 血液 pH 4.7--8.4 0.9-1.5 7.35-7.45 A.人體的尿液一定呈酸性 B.人體的血液一定呈堿性 C.人體的胃液能使紫色石蕊試液變藍色 D.pH試紙可精確測得以上體液的pH 組卷:1引用:2難度:0.5 -
4.在四個小燒杯中分別盛放相同質量的下列物質。在空氣中放置一段時間后,燒杯內物質的質量因發生物理變化而增加的是( )
A.濃鹽酸 B.生石灰 C.濃硫酸 D.氫氧化鈉溶液 組卷:1引用:3難度:0.5 -
5.下列化學方程式正確的是( )
A.Fe+2AgCl=2Ag+FeCl2 B.Cu+H2SO4=CuSO4+H2↑ C.CaCO3+Ba(OH)2=BaCO3↓+Ca(OH)2 D.FeO+2HCl=FeCl2+H2O 組卷:24引用:1難度:0.5 -
6.金屬鈀(Pd)是種用于制首飾的銀白色貴金屬,現進行如下三個實驗:
由上述現象可知,鈀在金屬活動性順序中位于( )實驗一 實驗二 實驗三 實驗操作 將鈀絲伸入稀鹽酸 將銀絲伸入PdCl2溶液 將鉑絲伸入PdCl2溶液 實驗現象 無明顯現象 銀絲表面析出固體 溶液中出現白色沉淀 無明顯現象 A.氫之前 B.銀和鉑之間 C.氫和銀之間 D.鉑之后 組卷:25引用:8難度:0.5 -
7.某科學興趣小組要在實驗室制取一定量的MgSO4.同學們分別在實驗室里找到了以下四種反應物,其中不能通過與稀硫酸反應制得MgSO4的是( )
A.Mg B.MgO C.Mg(OH)2 D.MgCl2 組卷:5引用:4難度:0.7 -
8.氫氧化銫是一種可溶性堿,其化學式為CsOH,則下列敘述中正確的是( )
A.CsOH 溶液的pH小于7 B.CsOH 和CuO能發生化學反應 C.CsOH 溶液能使酚酞試液變藍 D.CsOH 中Cs元素化合價為+1價 組卷:5引用:5難度:0.5 -
9.類推是科學學習中常用的思維方法。以下說法錯誤的是( )
①鐵能置換出硫酸銅溶液中的銅,所以也能置換出硫酸鎂溶液中的鎂
②NaOH 能使紫色石蕊試液變藍,所以Cu(OH)2 也能使能使紫色石蕊試液變藍
③NH4Cl 不能與堿性物質混合使用,所以尿素 CO(NH2)2 也不能與堿性物質混合使用
④酸在水溶液中能電離出H+,所以能電離出H+的一定是酸A.只有①② B.只有①③ C.只有②③ D.①②③④ 組卷:57引用:4難度:0.5 -
10.為完全中和某鹽酸溶液,需100克質量分數為4%的NaOH溶液。如果改用100克質量分數為4%的KOH溶液,反應后溶液的pH為( )
A.大于7 B.小于 C.等于7 D.無法判斷 組卷:4引用:1難度:0.5 -
11.某校甲、乙、丙、丁四位同學學習了酸、堿、鹽的化學性質后,分別設計了下列有關物質鑒別的方案,其中可行的是( )
甲:利用酚酞試液鑒別Na2CO3、NaCl和稀硫酸三種溶液;
乙:利用CO2氣體鑒別NaOH、Ca(OH)2和稀鹽酸三種溶液;
丙:利用稀硫酸鑒別KOH、Na2CO3和BaCl2三種溶液;
丁:不用其它任何試劑將HCl、CaCl2、Na2CO3、NaCl四種溶液鑒別出來。A.只有甲和乙 B.只有丙和丁 C.只有甲、乙和丙 D.甲、乙、丙和丁都可以 組卷:108引用:4難度:0.5 -
 12.用如圖所示的密閉實驗裝置,能夠使氣球先膨脹,過一段時間又恢復到原狀的一組固體和液體是( )
12.用如圖所示的密閉實驗裝置,能夠使氣球先膨脹,過一段時間又恢復到原狀的一組固體和液體是( )A.固體:硝酸銨;液體:水 B.固體:碳酸鈉;液體:稀鹽酸 C.固體:生石灰;液體:水 D.固體:氯化鈉;液體:水 組卷:43引用:4難度:0.5
四、計算題(4+6+8+8分=26分)
-
37.“莊稼一枝花,全靠肥當家”。有一種新型化肥——硝酸銨鈣,其有效成分為NH4NO3和Ca(NO3)2,進入土壤后,都成為可吸收的離子,不會引起土壤板結,且鈣離子可提高農作物對病害的抵抗力。小寧利用某品牌的硝酸銨鈣化肥,進行以下實驗:取化肥樣品4.0g,與足量的NaOH固體充分混合,加熱到固體質量不再減少,生成0.17g氨氣(NH3)。把反應所得固體溶于適量水中,再加入足量的Na2CO3溶液充分反應,過濾得到沉淀和濾液,測得沉淀質量為8.0g。(已知:NH4NO3+NaOH
NaNO3+NH3↑+H2O;化肥中的其它成分不含Ca、N元素,且不參加反應)△
(1)作為氮肥,硝酸銨鈣在植物生活中的主要作用是。
A.促進幼苗的生長發育和開花,使果實、種子的成熟提早
B.使莖桿健壯,促進淀粉的形成
C.促進細胞分裂和生長,使枝葉長得繁茂
(2)計算樣品中NH4NO3的質量分數。
(3)計算濾液中NaNO3的質量。組卷:10引用:1難度:0.5 -
38.利用海水吸收含硫煙氣中的SO2并生產石膏(主要成分CaSO4?2H2O)的主要物質轉化關系如圖1:
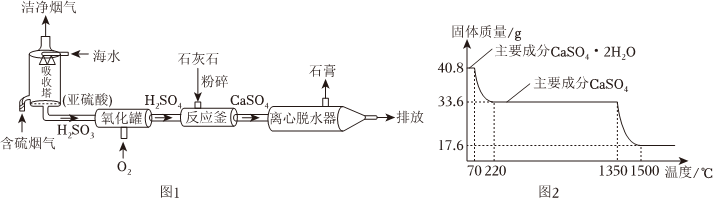 ?
?
(1)反應塔中,石灰石在加入前,需將其粉碎的目的是。
(2)現取40.8g石膏藥品進行加熱,固體質量隨溫度的變化如圖2(雜質不參加反應且不含鈣元素)。
①石膏開始分解的溫度是。
②計算40.8g該石膏樣品中含有CaSO4?2H2O的質量。(寫出計算過程)
③1350~1500℃時,繼續分解生成氧化鈣、二氧化硫和氧氣,最終剩余的17.6g固體中含有CaO的質量為g。組卷:33引用:1難度:0.5


