2021-2022學年河南省部分名校高二(上)期中化學試卷
發布:2024/11/28 20:0:2
一、選擇題(本大題共15小題,每小題3分,共計45分。在每小題列出的四個選項中,只有一項是符合題目要求的)
-
1.我國提出爭取在2030年前實現碳達峰,2060年實現碳中和,這對于改善環境,實現綠色發展至關重要。下列措施中能促進碳中和最直接有效的是( )
A.減少氟氯烴化物的排放 B.用脫硫煤代替原料煤做燃料 C.大規模開采可燃冰作為新能源 D.加強二氧化碳的捕集和再利用 組卷:7引用:2難度:0.8 -
2.下列反應過程中能量的變化與其他三項不同的是( )
選項 A B C D 反應過程 氫氣燃燒 C還原CuO 鐵釘生銹 酸堿中和 A.A B.B C.C D.D 組卷:3引用:3難度:0.5 -
3.下列做法的目的與改變化學反應速率無關的是( )
A.瓜子包裝內放置除氧劑 B.青香蕉和蘋果放一起催熟 C.食鹽中添加碘酸鉀 D.紅薯放在地窖中保存 組卷:1引用:3難度:0.7 -
4.下列能說明溶液一定呈中性的是( )
A.c(H+)=c(OH-) B.滴入酚酞不變色 C.CH2COONa溶液 D.pH=7的溶液 組卷:14引用:4難度:0.7 -
5.下列說法正確的是( )
A.能量達到活化能的分子發生的碰撞均為有效碰撞 B.H+和OH-的反應活化能接近于零,反應幾乎在瞬間完成 C.升高溫度,可以提高活化分子的能量,會減慢反應速率 D.選用適當的催化劑,分子運動加快,增加了碰撞頻率 組卷:72引用:4難度:0.5 -
 6.298K、101kPa時,HCN(g)?HNC(g)異構化反應過程的能量變化如圖所示。下列說法正確的是( )
6.298K、101kPa時,HCN(g)?HNC(g)異構化反應過程的能量變化如圖所示。下列說法正確的是( )A.HNC比HCN穩定 B.正反應的活化能小于逆反應的活化能 C.該異構化反應的ΔH=+59.3kJ?mol-1 D.使用催化劑,可以改變反應的反應熱 組卷:6引用:5難度:0.5
二、非選擇題(本題共5小題,共55分)
-
19.氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,合成氨工業在國民生產中有重要意義。回答下列問題:
(1)若在容積為2L的密閉容器中充入0.2molN2和0.6molH2在一定條件下發生反應:N2(g)+3H2(g)?2NH3(g) ΔH<0,若在5min時反應達到平衡,此時測得NH3的物質的量為0.2mol。
①平衡時H2的轉化率為。
②平衡后,若是提高H2的轉化率,可以采取的措施有(填字母)。
A.加了催化劑
B.增大容器體積
C.降低反應體系的溫度
D.充入一定量N2
③若在0.5L的密閉容器中,一定量的氮氣和氫氣進行反應:N2(g)+3H2(g)?2NH3(g) ΔH<0,其化學平衡常數K與溫度T的關系如表所示:
K1T/℃ 200 300 400 K K1 K2 0.5 (填“<”“>”或“=”,下同)K2;400℃時,當測得NH3、N2和H2物質的量分別為3mol、2mol和1mol時,則該反應的v(N2)正v(N2)逆。
(2)用焦炭還原NO2的反應為2NO2(g)+2C(s)?N2(g)+2CO2(g),在恒溫條件下,1molNO2和足量C發生該反應,測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示: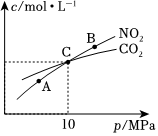
①A、B、C三點中NO2的轉化率最高的是(填“A”“B”或“C”)點。
②計算C點時該反應的壓強平衡常數KP(C)=(KP是用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。組卷:26引用:3難度:0.5 -
20.有A、B、C、D四種強電解質,它們在水中電離時可產生下列離子:(每種物質只含一種陽離子和一種陰離子且互不重復)
已知:A、C溶液呈堿性,濃度相同時C溶液pH大,B溶液呈酸性,D溶液焰色反應呈黃色;C溶液和D溶液相遇時生成白色沉淀。陽離子 Na+、Ba2+、NH4+、K+ 陰離子 AlO2-、Cl-、OH-、SO42-
(1)A的化學式是;
(2)寫出A溶液和B溶液反應的離子方程式:;
(3)25℃時,0.1mol?L-1 B溶液的pH=a,則B溶液中:c(H+)-c(OH-)=mol?L-1(用含有a的關系式表示);
(4)25℃時,1 mol?L-1的B溶液中c(H+)=mol?L-1(已知:B對應的酸/堿的電離常數K=1.8×10-5,≈2.36);5.56
(5)25℃時在一定體積0.1mol?L-1C溶液中,加入一定體積的0.1mol?L-1鹽酸時,混合溶液pH=13,則C溶液與鹽酸的體積比是;(溶液混合時體積變化忽略不計)
(6)常溫,將1mLpH=9的C溶液加水稀釋至1000mL,所得溶液中=c(H+)c(OH-);
(7)將等體積、等物質的量濃度的B溶液和C溶液混合,反應后溶液中各種離子濃度由大到小的順序為。組卷:20引用:3難度:0.6


