2022-2023學年江蘇省揚州中學教育集團樹人學校九年級(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共20小題,每小題2分,滿分40分)
-
1.正確的實驗操作是實驗成功的保證。如圖實驗操作正確的有( )
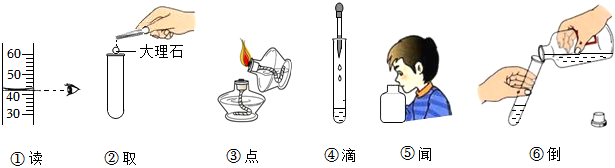
A.1個 B.2個 C.3個 D.4個 組卷:250引用:16難度:0.7 -
2.變化無處不在。下列防疫措施中一定發生化學變化的是( )
A.佩戴口罩 B.測量體溫 C.酒精消毒 D.掃吉祥碼 組卷:77引用:5難度:0.8 -
3.資料顯示:新冠病毒在高溫、堿性環境、高錳酸鉀和次氯酸鈉等消毒劑中生存能力較差,其中次氯酸鈉(NaClO)中氯元素的化合價為( )
A.-1 B.+1 C.0 D.+3 組卷:37引用:2難度:0.6 -
4.下列化學用語所表達的意義正確的是( )
A.Na--1個鈉元素 B.Cu2+--+2價銅元素 C.O--1個氧離子 D.2N2--2個氮分子 組卷:105引用:5難度:0.5 -
5.下列物質是由分子構成的是( )
A.水 B.氯化鈉 C.金剛石 D.銅 組卷:161引用:41難度:0.7 -
6.下列實驗現象描述正確的是( )
A.充分加熱碳酸氫銨固體,生成黑色物質 B.硫在氧氣中燃燒發出淡藍色火焰,生成無色無味的氣體 C.鐵絲在氧氣中燃燒,火星四射,放熱,生成黑色固體 D.“銅綠”與鹽酸混合,得到無色溶液 組卷:46引用:2難度:0.7 -
7.下列關于滅火的措施,不合理的是( )
A.正在使用的家用電器著火,立即用水澆滅 B.炒菜的油鍋著火,立即蓋上鍋蓋并關閉火源 C.燃著的酒精燈不慎碰倒失火,立即用濕布蓋滅 D.撲滅森林火災,鏟除火路走勢前方樹木設置隔離帶 組卷:217引用:6難度:0.5 -
8.下列物質中,屬于溶液的是( )
A.蒸餾水 B.牛奶 C.礦泉水 D.果粒橙 組卷:90引用:1難度:0.6
二、解答題(共6小題)
-
 25.某化學興趣小組對“影響金屬與鹽酸反應的劇烈程度的因素”進行了如下實驗探究,請你參與探究并回答相關問題。
25.某化學興趣小組對“影響金屬與鹽酸反應的劇烈程度的因素”進行了如下實驗探究,請你參與探究并回答相關問題。
【提出問題】金屬與鹽酸反應的劇烈程度受哪些因素的影響?
【作出猜想】猜想Ⅰ:可能與金屬本身的性質有關;
猜想Ⅱ:可能與鹽酸的濃度有關。
【分析交流】金屬鋁在空氣中會形成一層致密的氧化膜,有關反應的化學方程式為;為保證實驗的準確性,實驗所用金屬均用砂紙打磨。
【實驗探究】為探究猜想Ⅰ,取相同質量的鐵片和鋁片按圖1所示裝置進行實驗。
實驗觀察到甲試管中鐵片緩慢溶解,溶液由無色變為;乙試管中鋁片溶解較快。從實驗現象可判斷:鐵的金屬活動性比鋁;(選填“強”或“弱”)。
【得出結論】金屬與鹽酸反應的劇烈程度與金屬本身性質有關。
【繼續探究】為探究猜想Ⅱ,小組同學設計圖2所示的裝置進行實驗,所用藥品、實驗數據如表所示。
【得出結論】金屬與鹽酸反應的劇烈程度與鹽酸的濃度有關,其關系是實驗編號 選用金屬 鹽酸濃度(均取50mL) 每分鐘產生氣的體積/mL 1min 1~2min 2~3min 3~4min 4~5min 前5min共收集氣體 ① 鐵粉 15% 2.8 15.8 10.8 8.2 6.5 44.1 ② 鐵粉 5% 1.5 7.6 5.4 4.3 3.3 22.1 ;
【拓展與反思】根據表中數據分析,鐵粉與鹽酸反應最后變慢的原因是。組卷:59引用:3難度:0.6 -
26.金屬及其化合物在生產生活中應用廣泛。
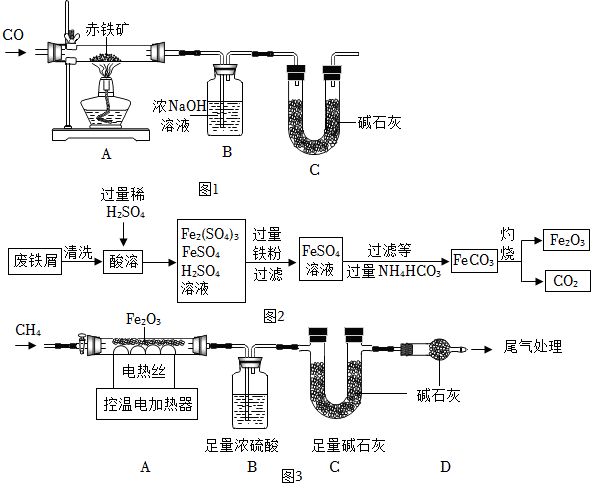
(一)鐵的冶煉
某化學實驗小組利用圖1裝置模擬鐵的冶煉并測定某赤鐵礦石中氧化鐵的質量分數(假設赤鐵礦中雜質赤鐵礦
不參與反應)
(1)實驗開始時,先進行的操作是(填字母)。
a.通入一氧化碳
b.加熱
(2)實驗過程中觀察到裝置A中玻璃管內發生反應的化學方程式。
(3)B裝置的作用是。
(4)從環境保護的角度看此實驗存在的缺陷是。
(5)實驗前稱量赤鐵礦石的質量為20g,通入足量一氧化碳充分反應,測得B裝置總質量增加13.2g。若不考慮實驗過程中水分帶出的影響,該赤鐵礦石中氧化鐵的質量分數。
(二)鐵的化合物制備
用廢鐵屑制備鐵紅(主要成分為Fe2O3)的部分流程如圖2所示:
(6)清洗時利用洗滌劑的作用,用其除廢鐵屑表面的油污。
(7)流程中加入的過量鐵粉除和Fe2(SO4)3發生化合反應外,還發生的反應化學方程式為。
(8)加過量NH4HCO3是為了將FeSO4溶液盡可能多的轉化為FeCO3,反應時溫度不宜過高的原因為。
(9)在空氣中灼燒FeCO3的反應為(寫化學方程式)。
(三)CH4還原Fe2O3的探究
取48.0gFe2O3粉末,用如圖3裝置進行實驗,并對反應及產物等作探究。
資料:①濃硫酸有吸水性,堿石灰可吸收H2O和CO2。②FeO+H2SO4=FeSO4+H2O。
(10)裝配好實驗裝置后,先要。
(11)加熱前后及過程中均通入CH4,停止加熱后繼續通CH4的目的是防止倒吸和。
(12)A中有如下反應:xCH4+4Fe2O38Fe+xCO2+yH2O,下列說法正確的是高溫(填序號)。
a、y=2x
b、裝置B、C增加的質量比為9:22
(13)控溫加熱一段時間后,繼續通CH4至冷卻,A中剩余的35.2g固體為Fe和FeO的混合物。在剩余固體中加一定量硫酸溶液,反應剛好完全。
①剩余固體中FeO質量為g。
②剩余固體和稀硫酸完全反應形成FeSO4的質量為g。組卷:292引用:1難度:0.4


