2021-2022學(xué)年內(nèi)蒙古呼倫貝爾市海拉爾二中高三(上)第三次段考化學(xué)試卷
發(fā)布:2024/9/14 5:0:10
一、單項(xiàng)選擇題(每小題3分,共42分)
-
1.化學(xué)與生產(chǎn)、生活、科技、環(huán)境等密切相關(guān)。下列說(shuō)法正確的是( )
A.為推動(dòng)生態(tài)文明建設(shè),我國(guó)近年來(lái)大力發(fā)展核電、光電、風(fēng)電、水電,電能屬于一次能源 B.打印機(jī)墨粉中常加有Fe3O4,這是利用了其有顏色和具有磁性的特點(diǎn),可用CuO替代Fe3O4 C.“天和”號(hào)核心艙上使用了目前世界上最先進(jìn)的三結(jié)砷化鎵太陽(yáng)能電池翼,砷化鎵屬于半導(dǎo)體材料 D.工業(yè)上通過(guò)將石灰石、石英、純堿混合熔融主要通過(guò)發(fā)生氧化還原反應(yīng)制備普通玻璃 組卷:17引用:6難度:0.7 -
2.下列實(shí)驗(yàn)現(xiàn)象與實(shí)驗(yàn)操作不相匹配的是( )
實(shí)驗(yàn)操作 實(shí)驗(yàn)現(xiàn)象 A 將盛有Fe(OH)3膠體的燒杯置于暗處,用紅色激光筆照射燒杯中的液體 在與光束垂直的方向看到一條光亮的“通路” B 向盛有少量Mg(OH)2沉淀的試管中加入適量飽和NH4Cl溶液,振蕩 白色沉淀溶解 C 向盛有3.0mL無(wú)水乙醇的試管中加入一小塊金屬鈉 有氣泡產(chǎn)生 D 向盛有2.0mL甲苯的試管中加入3滴酸性KMnO4溶液,用力振蕩 紫色不變 A.A B.B C.C D.D 組卷:406引用:3難度:0.5 -
3.下列各實(shí)驗(yàn)裝置圖的敘述中,正確的是( )
A. 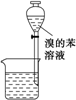
裝置①為放出萃取溴水后的苯層B. 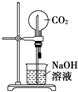
裝置②為噴泉實(shí)驗(yàn)C. 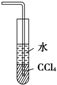
裝置③不能用來(lái)吸收HCl氣體D. 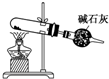
以NH4Cl為原料,裝置④可用于制備少量NH3組卷:4引用:6難度:0.7 -
4.對(duì)于下列描述的過(guò)程,能正確表示其反應(yīng)離子方程式的是( )
A.泡沫滅火器的滅火原理:Al3++3HCO3-═Al(OH)3↓+3CO2↑ B.將混有空氣的SO2 通入BaCl2 溶液中,出現(xiàn)白色渾濁:Ba2++SO2+H2O═BaSO3↓+2H+ C.將一小塊鐵片投入足量稀硝酸中:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O D.向NaHCO3溶液中加入稀鹽酸:CO32-+2H+═CO2↑+H2O 組卷:22引用:4難度:0.7 -
5.已知NA表示阿伏加德羅常數(shù),下列說(shuō)法正確的是( )
A.標(biāo)準(zhǔn)狀況下,22.4LNO與11.2LO2充分反應(yīng)后得到的氣體分子數(shù)為NA B.0.5mol?L-1 KNO3溶液中含有N原子總數(shù)為0.5NA C.1mol熔融NaHSO4電離出的陰、陽(yáng)離子總數(shù)目為2NA D.1molCH≡CH中含有共用電子對(duì)的數(shù)目為3NA 組卷:8引用:4難度:0.5 -
6.陰離子X(jué)n-含中子N個(gè),X的質(zhì)量數(shù)為A,則mgX元素的氣態(tài)氫化物中含質(zhì)子的物質(zhì)的量是( )
A. AM(n-N)molB. mA+N(n+N)molC. mA+n(A-N+n)molD. Am+N(m+n)mol組卷:719引用:50難度:0.7
二、填空題(本大題共5道小題,共58分)
-
18.丙烯是一種重要的化工原料,可以在催化劑作用下,由丙烷直接脫氫或氧化脫氫制備。
反應(yīng)Ⅰ(直接脫氫):C3H8(g)=C3H6(g)+H2(g)ΔH1反應(yīng)Ⅱ(氧化脫氫):2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g)ΔH2(1)對(duì)于反應(yīng)Ⅰ,總壓恒定為100kPa,在密閉容器中通入C3H8和N2的混合氣體(N2不參與反應(yīng)),從平衡移動(dòng)的角度判斷,達(dá)到平衡后“通入N2”的作用是;在溫度為T1時(shí),C3H8的平衡轉(zhuǎn)化率與通入氣體中C3H8的物質(zhì)的量分?jǐn)?shù)的關(guān)系如圖a所示,計(jì)算T1時(shí)反應(yīng)Ⅰ的平衡常數(shù)Kp=kPa(以分壓表示,分壓=總壓×物質(zhì)的量分?jǐn)?shù),保留一位小數(shù))。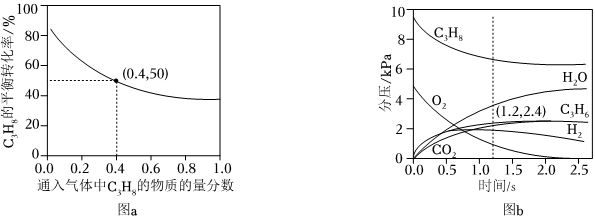
(2)在溫度為T2時(shí),通入氣體分壓比為p(C3H8):p(O2):p(N2)=10:5:85的混合氣體,各組分氣體的分壓隨時(shí)間的變化關(guān)系如圖b所示。0~1.2s生成C3H6的平均速率為kPa?s-1;在反應(yīng)一段時(shí)間后,C3H8和O2的消耗速率比小于2:1的原因?yàn)?nbsp;。
(3)恒溫剛性密閉容器中通入氣體分壓比為 p(C3H8):p(O2):p(N2)=2:13:85的混合氣體,已知某反應(yīng)條件下只發(fā)生如下反應(yīng)(k,k'為速率常數(shù)):
反應(yīng)Ⅱ:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g)k
反應(yīng)Ⅲ:2C3H6(g)+9O2(g)=6CO2(g)+6H2O(g)k'
實(shí)驗(yàn)測(cè)得丙烯的凈生成速率方程為v(C3H6)=kp(C3H8)-k'p(C3H6),可推測(cè)丙烯的濃度隨時(shí)間的變化趨勢(shì)為,其理由是。組卷:17引用:1難度:0.6 -
19.當(dāng)今,世界多國(guó)相繼規(guī)劃了碳達(dá)峰、碳中和的時(shí)間節(jié)點(diǎn)。因此,研發(fā)二氧化碳利用技術(shù),降低空氣中二氧化碳含量成為研究熱點(diǎn)。
(1)雨水中含有來(lái)自大氣的CO2,溶于水中的CO2進(jìn)一步和水反應(yīng)。發(fā)生電離:①CO2(g)?CO2(aq)②CO2(aq)+H2O(l)?H+(aq)+(aq)25℃時(shí),反應(yīng)②的平衡常數(shù)為K2。溶液中CO2的濃度與其在空氣中的分壓成正比(分壓=總壓×物質(zhì)的量分?jǐn)?shù)),比例系數(shù)為ymol?L-1?kPa-1。當(dāng)大氣壓強(qiáng)為pkPa,大氣中CO2(g)的物質(zhì)的量分?jǐn)?shù)為x時(shí),溶液中H+濃度為HCO-3mol?L-1(寫(xiě)出表達(dá)式,忽略的電離)。HCO-3
(2)105℃時(shí),將足量的某碳酸氫鹽(MHCO3)固體置于真空恒容容器中,存在如下平衡:2MHCO3(s)(g)上述反應(yīng)達(dá)平衡時(shí)體系的總壓為46kPa。保持溫度不變,開(kāi)始時(shí)在體系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡時(shí)體系中水蒸氣的分壓小于5kPa,CO2(g)的初始?jí)簭?qiáng)應(yīng)大于△M2CO3(s)+H2O(g)+CO2kPa。
(3)我國(guó)科學(xué)家研究Li-CO2電池,取得了重大科研成果。回答下列問(wèn)題:
①Li-CO2電池中,Li為單質(zhì)鋰片,則該電池中的CO2在(填“正”或“負(fù)”)極發(fā)生電化學(xué)反應(yīng)。研究表明,該電池反應(yīng)產(chǎn)物為碳酸鋰和單質(zhì)碳,且CO2電還原后與鋰離子結(jié)合形成碳酸鋰按以下4個(gè)步驟進(jìn)行,寫(xiě)出步驟Ⅲ的離子方程式。
Ⅰ.2CO2+2e-=C2O2-4
Ⅱ.C2=CO2+O2-4CO2-2
Ⅲ.
Ⅳ.+2Li+=Li2CO3CO2-3
②研究表明,在電解質(zhì)水溶液中,CO2氣體可被電化學(xué)還原。CO2在堿性介質(zhì)中電還原為正丙醇(CH3CH2CH2OH)的電極反應(yīng)方程式為。組卷:8引用:1難度:0.5


