2022-2023學年天津市寶坻一中高三(上)期末化學試卷
發布:2024/11/23 13:30:2
一、選擇題(每題3分,共36分)
-
1.下列說法正確的是( )
A.“結草為廬”所用的秸稈,經現代科技可轉化為苯乙酸、苯乙醇、苯乙烯等芳香烴 B.天和核心艙電推進系統腔體的氮化硼陶瓷屬于新型無機非金屬材料 C.太陽能電池翼伸展機構用到的SiC是一種新型硅酸鹽材料 D.滌綸、石墨烯、纖維素屬于有機高分子化合物 組卷:52引用:3難度:0.8 -
2.下列化學用語或圖示表達不正確的是( )
A.乙炔的結構簡式:HC≡CH B.順-2-丁烯的分子結構模型: 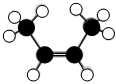
C.基態Si原子的價層電子的軌道表示式: 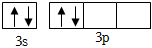
D.Na2O2的電子式: 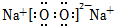 組卷:133引用:8難度:0.8
組卷:133引用:8難度:0.8 -
3.38Sr(鍶)的87Sr、86Sr穩定同位素在同一地域土壤中87Sr/86Sr值不變。土壤生物中87Sr/86Sr值與土壤中87Sr/86Sr值有效相關。測定土壤生物中87Sr/86Sr值可進行產地溯源。下列說法不正確的是( )
A.Sr位于元素周期表中第六周期、第ⅡA族 B.可用質譜法區分87Sr和86Sr C.87Sr和86Sr含有的中子數分別為49和48 D.同一地域產出的同種土壤生物中87Sr/86Sr值相同 組卷:382引用:6難度:0.8 -
4.用NA表示阿伏加德羅常數的值,下列有關敘述錯誤的是( )
A.含有3molC-C鍵的石墨中含有的碳原子數為2NA B.標準狀況下,22.4LCH4與22.4LCl2充分反應,生成的氣體分子數大于NA C.分別向含0.1mol氯化鐵的溶液中加入足量鎂粉和銅粉,轉移的電子數目均為0.1NA D.用鉛蓄電池電解氯化鈉溶液,當消耗4mol硫酸時,產生H2分子數目為2NA 組卷:23引用:2難度:0.6 -
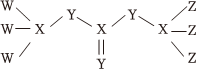 5.FEMC是鋰電池電解液中常用的一種物質,由原子序數依次增大的短周期元素W、X、Y、Z組成,其結構如圖所示,其中Z元素在其化合物中只會顯示一種價態。下列說法正確的是( )
5.FEMC是鋰電池電解液中常用的一種物質,由原子序數依次增大的短周期元素W、X、Y、Z組成,其結構如圖所示,其中Z元素在其化合物中只會顯示一種價態。下列說法正確的是( )A.最高化合價:Y>X>W B.W的簡單離子半徑一定小于周期表中其它所有元素簡單離子的半徑 C.Z單質在一定條件下可置換出Y單質 D.Y的氫化物的穩定性一定強于X的氫化物的穩定性 組卷:74引用:7難度:0.6
二、解答題(共4小題,滿分0分)
-
15.實驗室利用FeCl2?4H2O和亞硫酰氯(SOCl2)制備無水FeCl2的裝置如圖所示(加熱及夾持裝置略)已知SOCl2沸點為76℃,遇水極易反應生成兩種酸性氣體。回答下列問題:
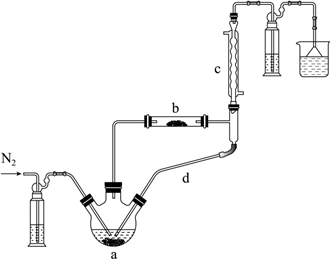
(1)實驗開始先通N2。一段時間后,先加熱裝置(填“a”或“b”),裝置b內發生反應的化學方程式為,裝置c的名稱是,裝置c、d共同起到的作用是。
(2)現有含少量雜質的FeCl2?nH2O,為測定n值進行如下實驗:
實驗Ⅰ:稱取m1g樣品,用足量稀硫酸溶解后,用cmol?L-1K2Cr2O7標準溶液滴定Fe2+達終點時消耗VmL(滴定過程中Cr2O72-轉化為Cr3+,Cl-不反應)。
實驗Ⅱ:另取m1g樣品,利用上述裝置與足量SOCl2反應后,固體質量為m2g。
則n=;滴定時發生的離子方程式為。下列情況會導致n測量值偏小的是(填標號)
A.樣品中含少量FeO雜質
B.樣品與SOCl2反應時失水不充分
C.實驗Ⅰ中,稱重后樣品發生了潮解
D.滴定達終點時發現滴定管尖嘴內有氣泡生成
(3)用上述裝置、根據反應TiO2+CCl4TiCl4+CO2制備TiCl4。已知TiCl4與CCl4分子結構相似,與CCl4互溶,但極易水解。選擇合適儀器并組裝蒸餾裝置對TiCl4、CCl4混合物進行蒸榴提純(加熱及夾持裝置略),安裝順序為①⑨⑧△(填序號),先餾出的物質為。 組卷:36引用:1難度:0.5
組卷:36引用:1難度:0.5 -
16.氫氣是一種理想的綠色能源。利用生物質發酵得到的乙醇制取氫氣,具有良好的應用前景。乙醇和水蒸氣重整制氫的部分反應過程如圖所示:
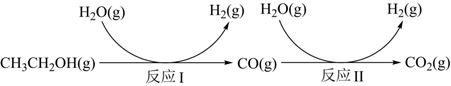
已知:反應Ⅰ和反應Ⅱ的平衡常數隨溫度變化曲線如圖所示。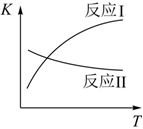
(1)反應Ⅰ中,1molCH3CH2OH(g)參與反應后的熱量變化是236kJ。
①反應Ⅰ的熱化學方程式是。
②反應Ⅰ在較高溫度下能夠自發進行的原因是。
③已知絕熱恒壓下,下列說法能夠判斷反應Ⅰ達到化學平衡狀態的是(填字母)。
A.CO的含量保持不變
B.容器中壓強保持不變
C.2v正(CO)=v逆(CH3CH2OH)
D.體系的溫度保持不變
(2)反應Ⅱ中:
①某溫度下,已知CO和H2O的起始濃度總和為5mol/L,且=1.5的投料比下,CO的平衡轉化率為40%,該溫度下反應平衡常數的值為n(CO)n(H2O)。
②當不同的進氣比達到相同的CO平衡轉化率時,對應的反應溫度和進氣比的關系是[n(CO)n(H2O)]。
(3)我國科學家設計了一種電解裝置如圖所示,能將二氧化碳轉化成合成氣CO和H2,同時獲得甘油醛(C3H6O3)。a極接電源的極;若陰離子交換膜只允許CO32-離子通過,當有5molCO32-通過時,理論上可制得甘油醛g。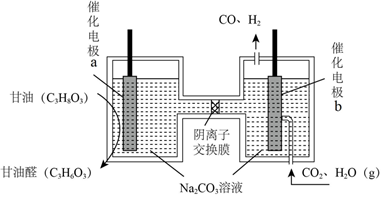 組卷:39引用:1難度:0.6
組卷:39引用:1難度:0.6


