2020-2021學年陜西省安康市漢濱區江北高級中學高一(下)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括18個小題,每小題3分,共54分。每小題僅有一個選項符合題意)
-
1.下列有關物質性質的比較正確的是( )
①同主族元素的單質從上到下,氧化性逐漸減弱,熔點逐漸升高
②元素的非金屬性越強,氣態氫化物的熱穩定性越弱
③單質與水反應的劇烈程度:F2>Cl2>Br2>I2
④元素的非金屬性越強,它的氣態氫化物水溶液的酸性越強
⑤還原性:S2->Se2-
⑥酸性:HNO3>H3PO4.A.①③ B.②④ C.③⑥ D.⑤⑥ 組卷:325引用:20難度:0.7 -
2.下列物質中不含離子鍵的是( )
①NH4HCO3
②NH3
③BaSO4;
④CH3COONa?3H2O
⑤Ba(OH)2
⑥H2SO4.A.①④⑥ B.②③⑤ C.④⑤ D.②⑥ 組卷:312引用:4難度:0.5 -
3.下列說法正確的是( )
A.離子鍵就是使陰、陽離子結合成化合物的靜電引力 B.所有金屬與所有非金屬之間都能形成離子鍵 C.在化合物CaCl2中,兩個氯離子之間也存在離子鍵 D.含有離子鍵的化合物一定是離子化合物 組卷:118引用:6難度:0.9 -
4.X元素最高氧化物對應的水化物為H2XO4,則它對應的氣態氫化物為( )
A.HX B.H2X C.XH4 D.XH3 組卷:161引用:40難度:0.9 -
5.下列事實不能作為實驗判斷依據的是( )
A.鈉和鎂分別與冷水反應,判斷金屬活動性強弱 B.鐵投入CuSO4溶液中,能置換出銅,鈉投入CuSO4溶液中不能置換出銅,判斷鈉與鐵的金屬活動性強弱 C.酸性H2CO3<H2SO4,判斷硫與碳的非金屬性強弱 D.F2與Cl2分別與H2反應,判斷氟與氯的非金屬性強弱 組卷:208引用:11難度:0.7 -
6.短周期元素W、X、Y、Z和原子序數依次增大,W與Y、X與Z分別位于同一主族,W與X可形成共價化合物WX2,Y原子的內層電子總數是其價電子數的2.5倍。下列敘述不正確的是( )
A.WX2分子中的所有原子最外層都為8電子結構 B.BX2、ZX2的化學鍵類型相同 C.YX2是共價化合物 D.原子半徑:X<W<Y<Z 組卷:3引用:3難度:0.6 -
7.近年,科學家發現了116號元素Lv.下列關于293Lv和294Lv的說法錯誤的是( )
A.兩者中子數相差1 B.兩者質量數相差1 C.兩者電子數相差1 D.兩者互為同位素 組卷:96引用:2難度:0.5
二、非選擇題(46分)
-
21.某研究性學習小組設計了一組實驗來探究元素周期律。甲同學根據元素非金屬性與對應最高價含氧酸之間的關系,設計了如圖1裝置來一次性完成碳族元素中C與Si的非金屬性強弱比較的實驗研究;乙同學設計了如圖2裝置來驗證鹵族元素性質的遞變規律。A、B、C三處分別是沾有NaBr溶液的棉花、濕潤的淀粉KI試紙、濕潤紅紙。已知常溫下濃鹽酸與高錳酸鉀能反應生成氯氣。
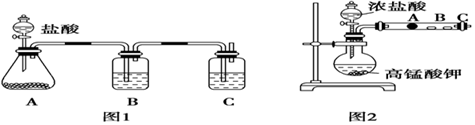
(1)寫出對應裝置中選用的物質:A,B,C;
(2)其中裝置B中所盛試劑的作用為;C中反應的離子方程式為。
(3)乙同學的實驗原理是;寫出B處的離子方程式:。組卷:21引用:2難度:0.3 -
22.W、X、Y、Z是原子序數依次增大的四種短周期元素。W的氣態氫化物能使紫色石蕊溶液變藍,W、X和Y三種元素的最高價氧化物的水化物兩兩之間可以發生反應,W、X、Y、Z的最外層電子數之和為16.回答下列問題:
(1)Z單質的電子式是。W的氣態氫化物能使紫色石蕊溶液變藍的原因:。(用化學方程式表示)
(2)X、Y、Z三種元素的簡單離子的離子半徑由大到小的順序是:。
(3)Z最高價氧化物對應的水化物化學式為。
(4)Z和氧元素、硫元素組成的SOZ2是一種液態化合物,沸點為77℃,遇水能劇烈水解,有白霧和帶有刺激性氣味的氣體逸出,該氣體可使滴有品紅試液的濾紙褪色。請寫出SOZ2和水反應的化學方程式。組卷:11引用:3難度:0.4


