2021-2022學年湖北省部分高中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括15小題,每小題3分,共45分,每小題只有一個選項符合題意)
-
1.反應A(g)+3B(g)═2C(g)+2D(g)在四種不同情況下的反應速率分別為
①v(A)=0.45mol?L-1?min-1
②v(B)=0.6mol?L-1?s-1
③v(C)=0.4mol?L-1?s-1
④v(D)=0.5mol?L-1?s-1
該反應進行的快慢順序為( )A.④>③>②>① B.④<③=②<① C.①>②>③>④ D.④>③=②>① 組卷:55引用:6難度:0.9 -
2.下列說法正確的是( )
A.增大反應物濃度,使活化分子百分數增加,化學反應速率增大 B.分子間的碰撞均為有效碰撞 C.增大壓強,活化分子百分數增加,化學反應速率一定增大 D.升高溫度,單位體積內分子總數不變,但活化分子數增加 組卷:45引用:2難度:0.7 -
3.已知每形成1mol有關化學鍵放出的能量為H-H:436kJ,N-H:391kJ,N≡N:946kJ,德國化學家哈伯從1902年開始研究由氮氣和氫氣直接合成氨,則常溫常壓下該反應的熱化學方程式為( )
A.N2(g)+3H2(g)═2NH3(g) ΔH=+184kJ/mol B.N2(g)+3H2(g)═2NH3(g)ΔH=-184kJ/mol C.N2(g)+3H2(g)═2NH3(g)ΔH=+92kJ/mol D.N2(g)+3H2(g)═2NH3(g)ΔH=-92kJ/mol 組卷:4引用:1難度:0.7 -
4.已知下列熱化學方程式:
(1)C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)ΔH=akJ/mol
(2)C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(l)ΔH=bkJ/mol
(3)C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)ΔH=ckJ/mol
(4)C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)ΔH=dkJ/mol
則下列關系正確的是( )A.b>a B.c>b C.d>c D.b>d 組卷:17引用:1難度:0.7 -
5.在密閉容器中,一定量的混合氣體發生反應:xA(g)+yB(g)?zC(g);平衡時測得A的濃度為0.50 mol?L-1,保持溫度不變,將容器的容積擴大到原來的3倍,再達平衡時,測得A的濃度降低為0.30 mol?L-1.下列有關判斷正確的是( )
A.x+y<z B.平衡向正反應方向移動 C.B的轉化率降低 D.C的體積分數增大 組卷:15引用:2難度:0.5 -
6.對于化學反應能否自發進行,下列說法錯誤的是( )
A.需要加熱才能夠進行的反應肯定不是自發反應 B.若ΔH<0,ΔS>0,則任何溫度下都能自發進行 C.若ΔH>0,ΔS<0,則任何溫度下都不能自發進行 D.非自發反應在一定條件下可能變成自發反應 組卷:7引用:2難度:0.7
二、填空題(本題包括4小題,共55分)
-
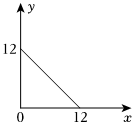 19.某溫度(T℃)下的溶液中,c(H+)=10-x mol?L-1,c(OH-)=10-y mol?L-1,x與y的關系如圖所示,請回答下列問題:
19.某溫度(T℃)下的溶液中,c(H+)=10-x mol?L-1,c(OH-)=10-y mol?L-1,x與y的關系如圖所示,請回答下列問題:
(1)此溫度下,水的離子積Kw為,則該溫度T25(填“>”、“<”或“=”).
(2)在此溫度下,向Ba(OH)2溶液中逐滴加入pH=a的鹽酸,測得混合溶液的部分pH如表所示.
假設溶液混合前后的體積變化忽略不計,則a=實驗序號 Ba(OH)2溶液的體積/mL 鹽酸的體積/mL 溶液的pH ① 22.00 0.00 8 ② 22.00 18.00 7 ③ 22.00 22.00 6 ,實驗②中由水電離產生的c(OH-)=mol?L-1.
(3)在此溫度下,將0.1mol?L-1的NaHSO4溶液與0.1mol?L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液顯甲 乙 丙 丁 0.1mol?L-1 Ba(OH)2溶液體積/mL 10 10 10 10 0.1mol?L-1 NaHSO4溶液體積/mL 5 10 15 20 (填“酸”、“堿”或“中”)性.
②寫出按乙方式混合后,反應的離子方程式:.
③按甲方式混合后,所得溶液的pH為.組卷:213引用:18難度:0.5 -
20.回答下列問題:
(1)用釘的配合物作催化劑,一定條件下可直接光催化分解CO2,發生反應:2CO2(g)═2CO(g)+O2(g),該反應的△H0,△S(填*>”“<“或“=”,上同)0,在低溫條件下,該反應(填“能“或“不能“)自發進行。
(2)已知在101 kPa、298 K時石灰石分解反應CacCO3(s)═CaO(s)+CO2 (g)的△H>0,△S>0,則:
①該反應常溫下(填“能”或“不能”)自發進行。
②據本題反應數據分析,溫度(填“能”或“不能”)成為反應方向的決定因素。
(3)某吸熱反應能自發進行,則該反應的△S(填“>”或“<”)0。組卷:16引用:2難度:0.7


