2022年江蘇省揚州市中考化學二模試卷
發布:2024/12/22 14:0:3
一、單項選擇題:本題包括20小題,每小題2分,共計40分。每小題只有一個選項符合題意。
-
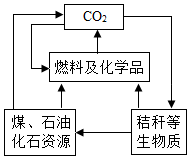 1.如圖是我國《可再生資源法》倡導的碳資源的轉化與循環利用示意圖。下列做法與該圖體現的理念不符的是( )
1.如圖是我國《可再生資源法》倡導的碳資源的轉化與循環利用示意圖。下列做法與該圖體現的理念不符的是( )A.將秸稈加工轉化為酒精燃料 B.二氧化碳作為原料生產尿素 C.過度開采煤、石油作為燃料 D.將石油精煉,制備合成材料 組卷:698引用:17難度:0.7 -
2.下列屬于化學變化的是( )
A.瓷碗破碎 B.糧食釀酒 C.甘蔗榨汁 D.白醋揮發 組卷:86引用:7難度:0.9 -
3.為維持人體內電解質平衡,人在大量出汗后應及時補充的離子是( )
A.Mg2+ B.Ca2+ C.Na+ D.Fe3+ 組卷:34引用:1難度:0.6 -
4.鉻酸鉛可用作黃色涂料,常用以下方法制取:K2CrO4+Pb(NO3)2═PbCrO4↓+2KNO3,該反應屬于( )
A.化合反應 B.分解反應 C.置換反應 D.復分解反應 組卷:129引用:7難度:0.9 -
5.“莊稼一枝花,全靠肥當家”.下列物質可作為氮肥的是( )
A.CaCl2 B.Ca(H2PO4)2 C.K2SO4 D.NH4HCO3 組卷:126引用:33難度:0.9 -
6.四種植物花汁在不同酸堿性下呈現的顏色如表所示。若要檢測某溶液的酸堿性,最好選用( )
pH <7 =7 >7 玫瑰花汁 粉紅 粉紅 黃 萬壽菊花汁 黃 黃 黃 大紅花汁 橙 粉紅 綠 萬年青花汁 橙黃 淺綠 淺綠 A.玫瑰花汁 B.萬壽菊花汁 C.大紅花汁 D.萬年青花汁 組卷:486引用:15難度:0.9 -
7.下列標志屬于中國節能標志的是( )
A. 
B. 
C. 
D.  組卷:222引用:14難度:0.9
組卷:222引用:14難度:0.9 -
8.下列化學儀器需墊加陶土網才能用酒精燈加熱的是( )
A.試管 B.燒杯 C.燃燒匙 D.蒸發皿 組卷:199引用:108難度:0.9
二、非選擇題
-
24.將Cl2用導管通入較濃的NaOH和H2O2的混和液中,在導管口與混和液的接觸處有閃爍的紅光出現,這是因為通氣后混和液中產生的ClOˉ(次氯酸根)與H2O2發生激烈反應,產生能量較高的氧分子,它立即轉變為普通氧分子,將多余的能量以紅光放出。進行此實驗,所用的儀器及導管如圖。
(1)已知實驗室制備Cl2的反應為MnO2+4HCl(濃)編號 ① ② ③ ④ ⑤ ⑥ 儀器及導管 
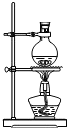
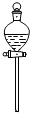
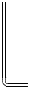
(一個)
(一個)
橡皮管MnCl2+Cl2↑+2H2O。組裝氯氣發生器時,應選用的儀器及導管(填寫圖中編號)是△。
(2)實驗進行中,按氣流方向從左到右的順序,氣體流經的各儀器及導管的編號依次是。
(3)儀器①的橡皮塞上應有個孔,原因是。
(4)實驗時,儀器①中除觀察到紅光外還有現象。
(5)實驗需用約10%H2O2溶液100mL,現用市售30%(密度近似為1g/cm3)H2O2來配制,其具體配制方法是。
(6)常溫時,Cl2能與NaOH溶液反應生成次氯酸鈉、氯化鈉和水。該反應的化學方程式為。組卷:10引用:2難度:0.4 -
 25.檸檬酸亞鐵(FeC6H6O7)是一種易吸收的高效鐵制劑,可由下列方法制得。表列出了該工藝中相關金屬離子生成氫氧化物沉淀的pH。
25.檸檬酸亞鐵(FeC6H6O7)是一種易吸收的高效鐵制劑,可由下列方法制得。表列出了該工藝中相關金屬離子生成氫氧化物沉淀的pH。
(l)將Na2CO3溶液緩慢加入到FeSO4溶液中,使其發生復分解反應,該反應的化學方程式為金屬離子 開始沉淀的pH 沉淀完全的pH Fe3+ 1.1 3.2 Al3+ 3.0 5.0 Fe2+ 5.8 8.8 。生成的FeCO3沉淀需經充分洗滌,檢驗洗滌是否完全的方法是。
(2)將制得的FeCO3加入到足量檸檬酸(分子式為C6H8O7)溶液中,發生反應FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O。再加入少量鐵粉(其作用是防止+2價的鐵與空氣中的O2反應生成+3價的鐵),80℃下攪拌反應。反應結束后,無需過濾,除去過量鐵粉的方法是。
(3)最后溶液經濃縮、加入適量無水乙醇、靜置、過濾、洗滌、干燥,獲得檸檬酸亞鐵晶體。分離過程中加入無水乙醇的目的是。
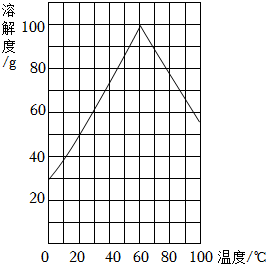
(4)某研究性學習小組欲從硫鐵礦燒渣(主要成分為Fe2O3、SiO2、Al2O3)出發,制備綠礬。請結合如圖的綠礬溶解度曲線,補充完整由硫鐵礦燒渣制備FeSO4?7H2O晶體的實驗步驟(可選用的試劑:鐵粉、稀硫酸和NaOH溶液)。向一定量燒渣中加入足量稀硫酸充分反應,過濾(其作用是除去不參加反應的SiO2),向濾液中加入足量鐵粉【其作用是使溶液中的Fe2(SO4)3轉化為FeSO4】,充分攪拌后,,得到FeSO4?7H2O晶體。
(5)為測定某FeSO4固體樣品中FeSO4的質量分數進行下列實驗:取2g樣品加水溶解并稀釋到100mL,取10mL稀釋后的溶液,當向其中加入1g 3.16%的KMnO4溶液時,兩者恰好完全反應。計算該FeSO4樣品中FeSO4的質量分數。寫出計算過程。(已知FeSO4與KMnO4反應時的化學計量數之比為5:1)組卷:36引用:1難度:0.5


