2021-2022學年山東省濰坊市臨朐實驗中學高二(上)月考化學試卷(1月份)
發(fā)布:2024/11/18 11:0:1
一、選擇題:本題共10小題,每小題2分,共20分,每小題只有一個選項符合題意。
-
1.下列價電子排布對應(yīng)的基態(tài)原子中,電負性最大的是( )
A.2s22p1 B.2s22p3 C.2s22p4 D.3s23p4 組卷:84引用:2難度:0.7 -
2.下列問題與鹽的水解有關(guān)的是( )
①熱的純堿溶液去油污效果好
②制備TiO2納米粉TiCl4+(x+2)H2O═TiO2?xH2O↓+4HCl
③為保存FeCl3溶液,要在溶液中加入少量鹽酸
④實驗室盛放NaOH溶液的試劑瓶不能用磨口玻璃塞
⑤加熱蒸干AlCl3溶液得到Al(OH)3固體
⑥鐵在潮濕的環(huán)境下生銹A.①②③⑤ B.②③④ C.①②③ D.全部 組卷:64引用:4難度:0.7 -
3.下列說法正確的是( )
A.1s電子云呈球形,表示電子繞原子核做圓周運動 B.第四周期基態(tài)原子未成對電子數(shù)為1的元素有4種 C.ns能級的能量一定高于(n-1)d能級的能量 D.元素周期表中ⅢB族到ⅡB族10個縱列的元素都是金屬元素 組卷:90引用:3難度:0.7 -
4.用學過的離子反應(yīng)的知識分析下列化學原理錯誤的是( )
A.“胃舒平”可以緩解胃酸過多:Al(OH)3+3H+═Al3++3H2O B.泡沫滅火器的滅火原理:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ C.加熱可以降低水的硬度:Ca2++2HCO3-═CaCO3↓+CO2↑+H2O D.KMnO4溶液測定補鐵劑中鐵的含量:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O 組卷:237引用:4難度:0.4 -
5.下列說法正確的是( )
A.Na2S溶液中存在平衡S2-+2H2O?H2S+2OH- B.常溫下,pH均為5的氯化銨溶液和醋酸溶液中水的電離程度相同 C.等物質(zhì)的量濃度①NH4Cl②NH4Al(SO4)2③NH4HSO4溶液中NH4+濃度的大小順序為①>②>③ D.相同溫度下,0.2mol?L-1醋酸溶液與0.1mol?L-1醋酸溶液中c(H+)之比小于2:1 組卷:31引用:4難度:0.7 -
6.純堿是重要的基礎(chǔ)化工原料,其產(chǎn)量和消費量通常作為衡量一個國家工業(yè)發(fā)展水平的指標。侯德榜先生為我國的制堿工業(yè)做出了突出的貢獻,制堿工業(yè)流程見圖。下列敘述錯誤的是( )
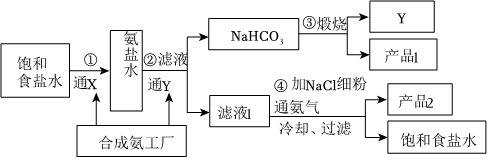
A.制得NaHCO3的原理為Na++NH3+H2O+CO2═ +NaHCO3↓NH+4B.通入CO2后,發(fā)生反應(yīng)2NH3?H2O+CO2═2 +NH+4+H2O、CO2-3+H2O+CO2═2CO2-3,提高了HCO-3濃度,利于析出NaHCO3沉淀HCO-3C.步驟④是為了析出更多的產(chǎn)品NH4Cl,提高食鹽利用率 D.侯氏制堿法中循環(huán)的物質(zhì)為CO2和NH3 組卷:211引用:3難度:0.4
三、根據(jù)題意填空、簡答:共5道題,60分,答案填寫在答題卡上。
-
19.國家標準(GB27602011)規(guī)定葡萄酒中SO2最大使用量為0.25g?L-1。某興趣小組用圖1裝置(夾持裝置略)收集某葡萄酒中的SO2,并對其含量進行測定。
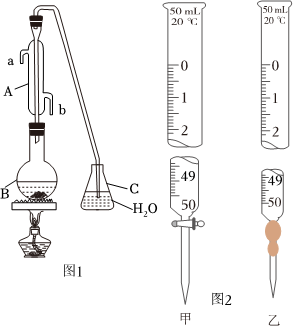
實驗步驟如下:
a.向B中加入300.00mL葡萄酒和適量稀硫酸,加熱,使SO2全部逸出并與C中的H2O2完全反應(yīng),加熱除去H2O2,得到待測液并稀釋至500mL。
b.取25.00mL待測液于錐形瓶中,加入指示劑,用0.0100mol?L-1NaOH標準液進行滴定。
c.數(shù)據(jù)處理:
回答下列問題:滴定次數(shù) 待測溶液的體積/mL 標準溶液的體積/mL 滴定前刻度 滴定后刻度 消耗標準溶液體積 1 25.00 0.10 7.60 2 25.00 7.60 15.00 3 25.00 0.20 7.80
(1)儀器A的名稱為。
(2)寫出C中發(fā)生的離子反應(yīng)。
(3)NaOH標準溶液盛裝在圖2中滴定管中(填標號)。若滴定終點溶液pH為8.8,則選擇的指示劑為;滴定過程中,眼睛應(yīng)注視;滴定終點的判斷為。
(4)根據(jù)表格中的數(shù)據(jù)計算該葡萄酒中SO2含量為g?L-1。
(5)下列操作會導致實驗結(jié)果偏低的是。(填標號)
a.滴定管在裝液前未用標準溶液潤洗
b.滴定過程中,錐形瓶振蕩得太劇烈,錐形瓶內(nèi)有液滴濺出
c.達到滴定終點時,仰視讀數(shù)
d.裝標準溶液的滴定管尖嘴部分在滴定前沒有氣泡,滴定終點時發(fā)現(xiàn)氣泡組卷:27引用:4難度:0.5 -
20.As2S3可轉(zhuǎn)化為用于治療白血病的亞砷酸(H3AsO3)。亞砷酸在溶液中存在多種微粒形態(tài),各種微粒的物質(zhì)的量分數(shù)與溶液pH的關(guān)系如圖1所示。請回答下列問題:

(1)人體血液的pH為7.35~7.45,用藥后人體中含砷元素的主要微粒是。
(2)亞砷酸是酸(填“強”或“弱”),Ka1=。
(3)寫出溶液pH由11至12的過程中發(fā)生主要反應(yīng)的離子方程式。
(4)工業(yè)含砷廢水常用鐵鹽處理后排放。其原理是:鐵鹽混凝劑在溶液中產(chǎn)生Fe(OH)3膠粒,其表面帶有正電荷,可吸附含砷化合物。通過實驗測得不同pH條件下鐵鹽對含砷化合物的去除率,如圖2所示。請說明pH對去除率的影響,并解釋原因。組卷:23引用:3難度:0.6


