2021-2022學年江蘇省鹽城市阜寧中學高二(下)第一次段考化學試卷
發布:2024/12/11 7:0:2
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.化學反應速率和化學平衡在工農業生產和日常生活中都有重要應用。下列說法不正確的是( )
A.含氟牙膏能防治齲齒,使人們的牙齒更健康 B.催化劑能加快反應速率,并提高原料的平衡轉化率 C.夏天面粉發酵速度與冬天面粉發酵速度相差較大 D.鹽堿地(含較多NaCl、Na2CO3)不利于作物生長,可通過施加適量石膏降低土壤的堿性 組卷:23引用:3難度:0.7 -
2.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.0.1mol/L碳酸氫鈉溶液中:K+、Fe3+、NO3-、SO42- B.由水電離產生c(H+)=10-12mol/L的溶液中:Na+、Ba2+、Cl-、NO3- C.能使甲基橙變紅的溶液中:Al3+、Ca2+、ClO-、CH3COO- D. =1012的溶液中:NH4+、K+、Cl-、Br-c(OH-)c(H+)組卷:9引用:1難度:0.7 -
3.下列說法或表示方法正確的是( )
A.吸熱反應一定需要加熱才能發生 B.氫氣與氧氣反應生成等量的液態水和水蒸氣,后者放出的熱量多 C.1mol硫完全燃燒放熱297.3kJ,其熱化學方程式為:S+O2═SO2△H=-297.3kJ/mol D.在稀溶液中:H+(aq)+OH-(aq)═H2O(1),△H=-57.3kJ/mol,若將含0.5molH2SO4的稀硫酸與含1.1molNaOH的稀溶液混合,放出的熱量等于57.3kJ 組卷:25引用:7難度:0.6 -
4.下列離子方程式表達正確的是( )
A.用飽和碳酸鈉處理重晶石:BaSO4+CO32-?BaCO3+SO42- B.用銅電極電解CuSO4溶液:2Cu2++4OH- 2Cu+O2↑+2H2O通電C.Na2S的水解:S2-+2H2O?H2S+2OH- D.向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═SO32-+2HClO 組卷:10引用:1難度:0.7 -
5.下列各圖所示裝置能達到實驗目的的是( )
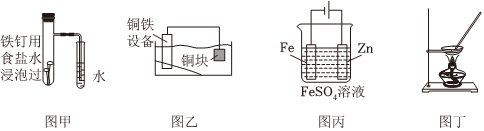
A.圖甲,驗證鐵的吸氧腐蝕 B.圖乙,保護水體中的鋼鐵設備 C.圖丙,在鐵制品表面鍍鋅 D.圖丁,蒸干FeCl3溶液制FeCl3固體 組卷:18引用:4難度:0.6
二、解答題(共3小題,滿分0分)
-
16.亞氯酸鈉(NaClO2)是一種高效的消毒劑和漂白劑,工業上以氯酸鈉(NaClO3)為原料制備NaClO2的流程如下:
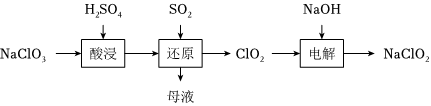
(1)“還原”得到ClO2氣體,母液中溶質的主要成分是(填化學式),NaClO3與SO2發生反應的離子方程式為。
(2)分析電解一段時間后溶液中ClO2的含量。
已知:①ClO2被I-還原為、Cl-的轉化率與溶液pH的關系如圖所示。ClO-2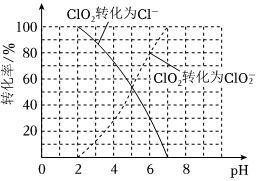
②當pH≤2時,也能被I-完全還原為Cl-。ClO-2
③反應生成的I2用標準Na2S2O3溶液滴定:Na2S2O3+I2-Na2S4O6+NaI(未配平)
準確量取500mL水樣加入到錐形瓶中,加入NaOH溶液調節pH為7~8,加入足量KI晶體,充分攪拌后,滴加幾滴淀粉溶液,用0.2000mol/L標準Na2S2O3溶液滴定至終點,滴定終點的現象是,消耗Na2S2O3溶液20.00mL。計算電解后所得溶液中ClO2的含量(mg/L)(寫出計算過程)。組卷:8引用:2難度:0.5 -
17.研發CO2資源化利用技術,降低空氣中CO2含量成為世界各國研究熱點。
Ⅰ.CO2和H2催化合成CH4
主要發生反應為CO2+4H2=CH4+2H2O。一定溫度和壓強下,將一定比例CO2和H2分別通過裝有兩種不同催化劑的反應器,反應相同時間,測得CO2轉化率隨溫度變化情況如圖所示。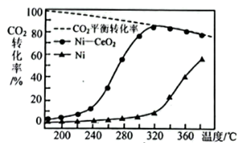
(1)高于320℃后,用Ni作催化劑,CO2轉化率明顯上升,其原因是。
(2)高于320℃后,用Ni-CeO2作催化劑,CO2轉化率略有下降,可能原因是。
Ⅱ.CO2與H2合成二甲醚(CH3OCH3)
該工藝主要涉及三個反應:
反應A:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)ΔH=-49.01kJ?mol-1
反應B:CO2(g)+H2(g)═CO(g)+H2O(g)ΔH=+41.17kJ?mol-1
反應C:2CH3OH(g)═CH3OCH3(g)+H2O(g)ΔH=-24.52kJ?mol-1
(3)一定溫度下,向1L恒容密閉容器中加入0.25molCO2和1.0molH2發生上述3個反應,達到平衡時測得部分物質的濃度如表所示:
則CO2的平衡轉化率α=成分 CO CO2 CH3OCH3 濃度/mol?L-1 8×10-3 0.17 3×10-2 ,平衡時CO2轉化為CH3OCH3的選擇性=(選擇性是指生成指定物質消耗的CO2占CO2消耗總量的百分比)。
(4)在壓強3.0MPa,=4時,不同溫度下CO2的平衡轉化率和產物的選擇性如圖所示。n(H2)n(CO2)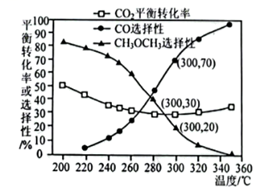
①當溫度超過290℃,CO2的平衡轉化率隨溫度升高而增大的原因是。
②不改變反應時間和溫度,一定能提高CH3OCH3選擇性的措施有。組卷:22引用:2難度:0.6


