2020-2021學年海南省海口市海南中學高三(上)第五次月考化學試卷
發布:2024/11/19 14:0:1
一、選擇題:本題共8小題,每小題2分,共16分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.油炸蝦條、薯片等容易擠碎的食品,一般用充氣袋包裝。充氣袋中適宜填充的氣體是( )
A.N2 B.SO2 C.H2 D.NH3 組卷:113引用:2難度:0.8 -
2.以下列出的是基態原子2p軌道中電子排布的情況,違反洪特規則的是( )

A.① B.② C.③ D.①② 組卷:12引用:1難度:0.8 -
3.氧化鋁用來制造耐火坩堝、耐火管和耐高溫的實驗儀器,是利用了氧化鋁( )
A.是白色固體 B.不溶于水 C.熔點很高 D.是金屬氧化物 組卷:9引用:1難度:0.8 -
4.673K時,NO2+CO═NO+CO2的基元反應歷程圖如圖。下列說法正確的是( )
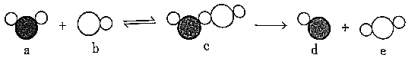
A.圖中5種物質中c最不穩定 B.反應過程中所有化學鍵都斷開 C.反應一定沒有能量變化 D.c分子間的碰撞全部是有效碰撞 組卷:4引用:1難度:0.7 -
5.下列有關實驗裝置及實驗方案的設計正確的是( )
選項 A B C D 實驗裝置 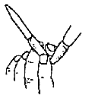
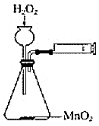
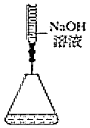

實驗設計 檢查堿式滴定管是否漏液 測定化學反應速率 量取15.00mLNaOH溶液 探究酸性:H2CO3>HClO A.A B.B C.C D.D 組卷:9引用:1難度:0.5 -
6.下列判斷不正確的是( )
A.Na2S2O3溶液中加入稀硫酸的離子方程式為:S2O32-+2H+═SO2↑+S↓+H2O B.CuCl2溶液中通入少量H2S溶液:Cu2++S2-═CuS↓ C.用TiCl4制備TiO2的反應可表示為:TiCl4+(x+2)H2O(過量)?TiO2?xH2O↓+4HCl D.用碳酸鈉溶液處理鍋爐水垢:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq) 組卷:4引用:1難度:0.7
三、解答題(共5小題,滿分60分)
-
18.某同學在實驗室進行鐵鹽與亞鐵鹽相互轉化實驗。
實驗Ⅰ:將Fe3+轉化為Fe2+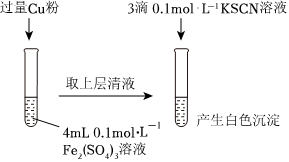
(1)Fe3+與Cu粉發生反應的離子方程式為。
(2)探究白色沉淀產生的原因,請填寫實驗方案:
查閱資料:實驗方案 現象 結論 步驟1:取4 mL mol?L-1 CuSO4溶液,向其中滴加3滴0.1mol?L-1KSCN溶液產生白色沉淀 CuSO4溶液與KSCN溶液反應產生了白色沉淀 步驟2:取 無明顯
現象
已知:①SCN-的化學性質與I-相似。
②2Cu2++4I-═2CuI↓+I2。
Cu2+與SCN-反應的離子方程式為。
實驗Ⅱ:將Fe2+轉化為Fe3+
探究上述現象出現的原因:實驗方案 現象 向3mL 0.1mol?L-1FeSO4溶液中加入1mL稀硝酸 溶液變為棕色,放置一段時間后,棕色消失,溶液變為黃色
查閱資料:Fe2++NO?Fe(NO)2+(棕色)
(3)用離子方程式解釋NO產生的原因。
(4)從化學反應速率與限度的角度對體系中存在的反應進行分析:反應Ⅰ:Fe2+與HNO3反應;反應Ⅱ:Fe2+與NO反應。
①依據實驗現象,可推知反應Ⅰ的速率比反應Ⅱ(填“快”或“慢”)。
②反應Ⅰ是一個不可逆反應,設計實驗方案加以證明。
③請用化學平衡移動原理解釋溶液由棕色變為黃色的原因。組卷:39引用:4難度:0.5 -
19.工業上用CO2氧化C2H6制C2H4是化工工業的一個新課題,相關主要化學反應有:
Ⅰ.C2H6(g)+CO2(g)?C2H4(g)+H2O(g)+CO(g)△H1=+177kJ?mol-1
Ⅱ.C2H6(g)+2CO2(g)?4CO(g)+3H2(g)△H2=+430kJ?mol-1
則(1)C2H6(g)+2CO(g)+3H2(g)?2C2H4(g)+2H2O(g)△H=kJ?mol-1
(2)反應Ⅱ反應Ⅰ(填“有利于”或“不利于”)中乙烯生成;一定溫度和壓強下,為了提高反應速率和乙烯的選擇性(乙烯的選擇性=),應當轉化為乙烯所消耗乙烷的量乙烷的總轉化量。
(3)容器體積為1.0L,控制C2H6和CO2初始投料量為2mol和3mol,乙烷的平衡轉化率、乙烯的選擇性與溫度、壓強的關系如圖所示。則X代表(填“溫度”或“壓強”);L1和L2哪個大?并說出理由:;M點反應Ⅰ的平衡常數為。(結果保留2位有效數字)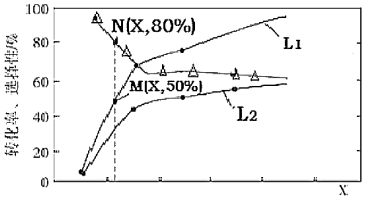
[標注△的是乙烯選擇性曲線,另外兩條是乙烷轉化率曲線。]組卷:3引用:1難度:0.4


