2021-2022學年黑龍江省雙鴨山一中高二(下)開學化學試卷
發(fā)布:2024/12/29 2:0:2
一、選擇題(每個只有一個正確答案,1-20題每題2分,21-25題每題3分,共55分)(題號下有下劃線的為改編及原創(chuàng)試題)
-
1.可以用分液漏斗分離的一組混合物是( )
A.乙酸和乙醇 B.苯和水 C.乙醇和水 D.溴和四氯化碳 組卷:26引用:1難度:0.7 -
2.實驗室有下列試劑,其中必須用帶橡膠塞的試劑瓶保存的是( )
①NaOH溶液 ②水玻璃 ③Na2S溶液 ④Na2CO3溶液 ⑤NH4Cl溶液 ⑥澄清石灰水 ⑦濃HNO3⑧濃H2SO4.A.①⑥ B.①②③④⑥ C.①②③⑥⑦⑧ D.⑤⑦⑧ 組卷:67引用:15難度:0.9 -
3.下列鐵制品防護的裝置或方法中,不正確的是( )
A. 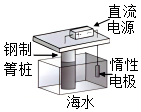
外加電流B. 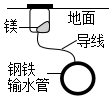
犧牲陽極C. 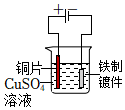
表面鍍銅D. 
制成不銹鋼組卷:43引用:4難度:0.7 -
4.下列有機物命名正確的是( )
A.3,3-二甲基丁烷 B.2-羥基戊烷 C.3-異丙基己烷 D.2-乙基-1-丁烯 組卷:32引用:1難度:0.9 -
5.下列化學原理的應用,主要用沉淀溶解平衡原理來解釋的是( )
①熱純堿溶液的洗滌油污能力強;
②誤將鋇鹽[BaCl2、Ba(NO3)2]當作食鹽食用時,常用0.5%的Na2SO4溶液解毒;
③溶洞、珊瑚的形成;
④碳酸鋇不能做“鋇餐”而硫酸鋇則能;
⑤泡沫滅火器滅火的原理.A.②③④ B.①②③ C.③④⑤ D.①②③④⑤ 組卷:304引用:24難度:0.9 -
6.室溫下,物質的量濃度相同的下列溶液,按pH由小到大的順序排列的是( )
A.Na2CO3、NaHCO3、NaCl、NH4Cl B.NH4Cl、NaCl、NaHCO3、NaHSO3 C.NH4HSO4、NH4Cl、NaNO3、NaHCO3、Na2CO3 D.NH4Cl、(NH4)2SO4、Na2S、NaNO3 組卷:36引用:1難度:0.7 -
7.在容積不變的密閉容器中存在如下反應:2A(g)+B(g)═3C(g)+D(s)△H<0,某研究小組研究了在其他條件不變時,改變某一條件對上述反應的影響,下列分析不正確的是( )
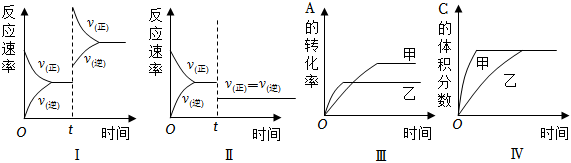
A.圖Ⅰ表示增加反應物濃度對該平衡的影響 B.圖Ⅱ表示減小壓強對該平衡的影響 C.圖Ⅲ表示溫度對該平衡的影響,溫度:乙>甲 D.圖Ⅳ表示催化劑對該平衡的影響,催化效率:甲>乙 組卷:164引用:25難度:0.9 -
8.下列五種烴①2-甲基丁烷②2,2-二甲基丙烷③戊烷④丙烷⑤丁烷,按沸點由高到低的順序排列的是( )
A.①>②>③>④>⑤ B.②>③>⑤>④>① C.③>①>②>⑤>④ D.④>⑤>②>①>③ 組卷:80引用:36難度:0.9 -
9.關于熱化學方程式,下列說法正確的是( )
A.2molSO2和1molO2充分反應后放出熱量196.6 kJ,則2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ?mol-1,若將含1molCH3COOH的醋酸溶液與含1molNaOH的溶液混合,放出的熱量小于57.3kJ C.等量的硫蒸氣和硫固體分別完全燃燒,后者放出熱量多 D.甲烷的燃燒熱為-890.3kJ/mol,則甲烷燃燒的熱化學方程式表示為CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol 組卷:49引用:1難度:0.7 -
10.常溫下有以下四種溶液,下列說法錯誤的是( )
① ② ③ ④ pH 12 12 2 2 溶液 氨水 NaOH溶液 醋酸溶液 鹽酸 A.溫度升高對④溶液的pH值無影響 B.分別加水稀釋10倍,四種溶液的pH:①>②>④>③ C.①與④等體積混合后,所得溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) D.若VaL④與VbL②混合后所得溶液的pH=3,則Va:Vb=11:9 組卷:55引用:1難度:0.7
二、填空(共45分)
-
29.用標準0.1000mol/L的NaOH溶液滴定未知濃度的鹽酸,選用甲基橙作為指示劑,請你回答下列問題:
(1)標準液應裝在式滴定管中,達到滴定終點時的現(xiàn)象為。
(2)滴定時實驗數(shù)據(jù)如表所示:
滴定后滴定管讀數(shù)實驗次數(shù)編號 待測鹽酸體積 滴入NaOH體積 1 20.00mL 21.90mL 2 20.00mL 21.70mL 3 20.00mL 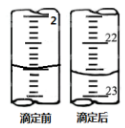 mL。求這種待測稀鹽酸的物質的量濃度c(HCl)=mol/L。
mL。求這種待測稀鹽酸的物質的量濃度c(HCl)=mol/L。
(3)用標準的NaOH溶液滴定未知濃度的鹽酸,選用酚酞作為指示劑,造成測定結果偏高的原因可能是。
A.滴定終點讀數(shù)時,俯視滴定管的刻度,其他操作正確
B.盛裝未知液的錐形瓶用蒸餾水洗過,未用未知液潤洗
C.滴定到終點讀數(shù)時,滴定管尖嘴處有氣泡
D.配制標準溶液的NaOH固體中混有Na2CO3雜質組卷:6引用:1難度:0.7 -
30.(1)大量的碘富集在海藻中,用水浸取后濃縮。濃縮液中含有I-、Cl-等離子,取一定量的濃縮液,向其中滴加AgNO3溶液,當AgCl開始沉淀時,溶液中
=c(I-)c(Cl-)。(已知Ksp(AgCl)=2×10-10,Ksp(AgI)=8.5×10-17)
(2)已知25℃,NH3?H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的濃度為2.0 mol/L,溶液中的c(OH-)=mol/L;將SO2通入該氨水中,當c(OH-)降至1.0×10-7mol/L時,溶液中的=c(SO32-)c(HSO3-)。
(3)在25℃下,將amol/L的氨水與0.01mol/L的鹽酸等體積混合,反應平衡時溶液中c(NH4+)=c(Cl-),則溶液顯性(填“酸”或“堿”或“中”);用含a的代數(shù)式表示NH3?H2O的電離常數(shù)Kb=。組卷:13引用:1難度:0.6


