2022年湖南省衡陽市衡陽一中高考化學二模試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題3分,共30分。每小題只有一個選項符合題意。
-
1.科技發展離不開化學。下列說法不正確的是( )
A.“直上云霄”:客機所用燃油是石油的分餾產物 B.“乘風破浪”:航母上的鈦合金鉚釘可抗海水腐蝕 C.“一帶一路”:絲綢制品成分的90%都是纖維素,能發生酯化反應 D.“筑夢天宮”:液氫、液氧替代四氧化二氮、偏二甲肼作為推進劑,對環境更友好 組卷:24引用:2難度:0.6 -
2.海洋中有豐富的食品、礦產、能源、藥物和水產資源,如圖為海水利用的部分過程。有關說法錯誤的是( )

A.制取NaHCO3的反應是利用其溶解度較小 B.侯氏制堿過程中應先通NH3再通CO2 C.在第②③④步驟中,溴元素均被氧化 D.③④的目的是進行溴的富集 組卷:104引用:2難度:0.5 -
3.下列說法正確的是( )
A.1mol?L-1AlCl3溶液中,含Al3+數目小于NA B.標準狀況下,6.0gNO和2.24LO2混合,所得氣體的分子數目為0.2NA C.25℃,1LpH=1的稀硫酸中含有的H+數為0.2NA D.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-數目為NA個 組卷:6引用:2難度:0.6 -
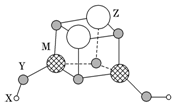 4.短周期元素X、Y、Z、M的原子序數依次增大,它們組成一種團簇分子,結構如圖所示。X、M的族序數均等于周期序數,Y原子核外最外層電子數是其電子總數的,下列說法正確的是( )34
4.短周期元素X、Y、Z、M的原子序數依次增大,它們組成一種團簇分子,結構如圖所示。X、M的族序數均等于周期序數,Y原子核外最外層電子數是其電子總數的,下列說法正確的是( )34A.簡單離子半徑:Z>M>Y B.第一電離能:Y>M>Z C.工業上常用電解熔融物ZY制取Z單質 D.Z、M的簡單離子均可促進水的電離 組卷:34引用:2難度:0.5 -
 5.常溫下,向 H2O2 溶液中滴加少量 Fe2(SO4)3溶液,反應原理如圖所示,下列說法正確的是( )
5.常溫下,向 H2O2 溶液中滴加少量 Fe2(SO4)3溶液,反應原理如圖所示,下列說法正確的是( )A.該反應過程中,M是Fe3+,M′是Fe2+ B.當有1mol O2 生成時,轉移2mol電子 C.在H2O2分解過程中,溶液的pH逐漸降低 D.H2O2的氧化性比Fe3+強,還原性比Fe2+弱 組卷:110引用:3難度:0.6 -
6.短周期主族元素X、Y、Z、W的原子序數依次增大,X的原子半徑比Y的小,Y原子最外層電子數是其內層電子總數的3倍,W原子的核電荷數等于X、Z原子的核電荷數之和,X和Z同主族.下列說法正確的是( )
A.原子半徑:r(W)>r(Z)>r(Y) B.Z的最高價氧化物對應水化物的堿性比W的強 C.化合物X2Y2和Z2Y2所含化學鍵類型完全相同 D.工業上常用電解熔融W的氧化物制備W的單質 組卷:73引用:7難度:0.7
三、非選擇題:本題共4小題,共50分。
-
18.研究氮、碳及其化合物的資源化利用具有重要的意義。
(1)過渡金屬催化還原氮氣合成氨具有巨大前景。催化過程一般有吸附-解離-反應-脫附等過程,圖示為N2和H2在固體催化劑表面合成氨反應路徑的勢能面圖(部分數據略),其中“*”表示被催化劑吸附。
氨氣的脫附是過程(填“吸熱”或“放熱”),合成氨的熱化學方程式為;
若將2.0mol N2和6.0mol H2通入體積為1L的密閉容器中,分別在T1和T2溫度下進行反應。曲線A表示T2溫度下n(H2)的變化,曲線B表示T1溫度下n(NH3)的變化,T2溫度下反應到a點恰好達到平衡。
①溫度T1(填“>”“<”或“=”下同)T2。T1溫度下恰好平衡時,曲線B上的點為b(m,n),則m12,n2;
②T2溫度下,若某時刻,容器內氣體的壓強為起始時的80%,則此時v(正)(填“>”“<”或“=”)v(逆)。
(2)以焦炭為原料,在高溫下與水蒸氣反應可制得水煤氣,涉及反應如下:
a.C(s)+H2O(g)?CO(g)+H2(g)ΔH1=+131.3kJ?mol-1K1
b.C(s)+2H2O(g)?CO2(g)+2H2(g)ΔH2=+90.3kJ?mol-1K2
c.CO(g)+H2O(g)?CO2(g)+H2(g)ΔH3=-41.0kJ?mol-1K3
三個反應的平衡常數隨溫度變化的關系如圖所示,則表示K1、K2、K3的曲線分別是、、。
(3)CO2在Cu-ZnO催化下,同時發生如下反應①、②,是解決溫室效應和能源短缺的重要手段。
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH1<0
②CO2(g)+H2(g)?CO(g)+H2O(g)ΔH2>0
在容積不變的密閉容器中,保持溫度不變,充入一定量的CO2和H2,起始及達平衡時,容器內各氣體的物質的量及總壓強如下表所示:
若容器內反應①、②均達到平衡時,P0=1.4p,反應①的平衡常數Kp=CO2 H2 CH3OH CO H2O 總壓強/KPa 起始/mol 0.5 0.9 0 0 0 P0 平衡/mol n 0.3 p (KPa)-2。(用含p的式子表示)組卷:85引用:4難度:0.5 -
19.2020年美國宣布批準Koseluge上市,給神性纖維瘤病兒童患者帶來福音,下圖是合成Koseluge的重要中間體的合成路線。

回答下列問題:
(1)B的結構簡式為:;系統命名法命名為。
(2)D的分子式為。
(3)由D生成E的化學方程式為。
(4)由E生成F和F生成G的反應類型分別為、。
(5)芳香化合物H是B的同分異構體,可以發生銀鏡反應,不與氯化鐵發生顯色反應,共有種,其中核磁共振氫譜為兩組峰的結構簡式為; (不考慮 O-F直接相連情況)
(6)請仿照以上路線,無機試劑任選,設計由 和
和 合成
合成 的路線。。組卷:35引用:3難度:0.5
的路線。。組卷:35引用:3難度:0.5


