新人教版選修4《第2章 化學反應速率和化學平衡》2015年單元測試卷(內蒙古滿洲里九中)
發布:2024/11/9 2:30:2
一、選擇題(共18小題,每小題3分,共54分,每小題只有一個選項符合題意)
-
1.反應A(g)+3B(g)?2C(g)+2D(g),在不同情況下測得反應速率如下,其中反應速率最快的是( )
A.υ(D)=0.4 mol/(L?s) B.υ(C)=0.5 mol/(L?s) C.υ(B)=0.6 mol/(L?s) D.υ(A)=0.15 mol/(L?s) 組卷:561引用:121難度:0.7 -
2.在2L密閉容器中加入4molA和6molB,發生以下反應:4A(g)+6B(g)?4C(g)+5D(g),若經5秒鐘后,剩下的A是2.5mol,則B的反應速率是( )
A.0.45mol/(L?s) B.0.15mol/(L?s) C.0.225mol/(L?s) D.0.9mol/(L?s) 組卷:121引用:23難度:0.9 -
3.可逆反應達到平衡的根本原因是( )
A.反應混合物中各組分的濃度相等 B.正逆反應都還在繼續進行 C.正逆反應的速率均為零 D.正逆反應的速率相等 組卷:243引用:25難度:0.9 -
4.已知反應mX(g)+nY(g)?qZ(g);△H<0,m+n>q,在恒容密閉容器中反應達到平衡時,下列說法正確的是( )
A.通入稀有氣體使壓強增大,平衡將正向移動 B.X的正反應速率是Y的逆反應速率的 倍mnC.降低溫度,混合氣體的平均相對分子質量變小 D.若平衡時X、Y的轉化率相等,說明反應開始時X、Y的物質的量之比為n:m 組卷:135引用:37難度:0.9 -
5.下列是4位同學在學習“化學反應的速率和化學平衡“一章后,聯系工業生產實際所發表的觀點,你認為不正確的是( )
A.化學反應速率理論是研究怎樣在一定時間內快出產品 B.化學平衡理論是研究怎樣使用有限原料多出產品 C.化學反應速率理論是研究怎樣提高原料轉化率 D.化學平衡理論是研究怎樣使原料盡可能多地轉化為產品 組卷:356引用:61難度:0.9 -
6.對某一可逆反應來說,使用催化劑的作用是( )
A.提高反應物的平衡轉化率 B.以同樣程度改變正逆反應的速率 C.增大正反應速率,減小逆反應速率 D.改變平衡混合物的組成 組卷:310引用:38難度:0.9 -
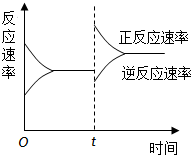 7.如圖是關于反應A2(g)+3B2(g)?2C(g)(正反應為放熱反應)的平衡移動圖象,影響平衡移動的原因可能是( )
7.如圖是關于反應A2(g)+3B2(g)?2C(g)(正反應為放熱反應)的平衡移動圖象,影響平衡移動的原因可能是( )A.升高溫度,同時加壓 B.降低溫度,同時減壓 C.增大反應物濃度,同時減小生成物濃度 D.增大反應物濃度,同時使用催化劑 組卷:827引用:46難度:0.9
二、填空(本題包括4個小題,共46分)
-
 21.(1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示,K值大小與溫度的關系是:溫度升高,K值(填一定增大、一定減小、或可能增大也可能減小)
21.(1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示,K值大小與溫度的關系是:溫度升高,K值(填一定增大、一定減小、或可能增大也可能減小)
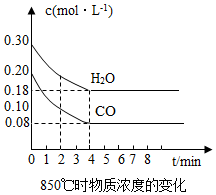
(2)在一體積為10L的容器中,通入一定量的CO和H2O,在850℃時發生如下反應:
CO(g)+H2O(g)═CO2(g)+H2(g)△H<0
CO和H2O濃度變化如圖所示,則0~4min的平均反應速率v(CO)=mol?L-1?min-1; 用H2表示在4~5min時的平均反應速率為
(3)t℃(高于850℃)時,在相同容器中發生上述反應,容器內各物質的濃度變化如上表所示:時間(min) CO H2O CO2 H2 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 c1 c2 c3 c3 4 c1 c2 c3 c3 5 0.116 0.216 0.084 6 0.096 0.266 0.104
①表中3min~4min之間反應處于狀態; c1數值0.08mol?L-1 (填大于、小于或等于)
②反應在4min~5min間,平衡向逆方向移動,可能的原因是(單選),表中5min~6min之間數值發生變化,可能的原因是(單選)
a.增加水蒸氣 b.降低溫度 c.使用催化劑 d.增加氫氣濃度。組卷:41引用:6難度:0.3 -
22.已知一定溫度和壓強下,在容積為VL的密閉容器中充入1mol A和1mol B,保持恒溫恒壓下反應:A(g)+B(g)?C(g)△H<0.達到平衡時,C的體積分數為40%.試回答有關問題:
(1)升溫時,C的反應速率(填“加快”、“減慢”或“不變”)。
(2)若平衡時,保持容器容積不變,使容器內壓強增大,則平衡。
A.一定向正反應方向移動 B.一定向逆反應方向移動
C.一定不移動 D.不一定移動
(3)若使溫度、壓強在上述條件下恒定不變,在密閉容器中充入2mol A和2mol B,則反應達到平衡時,C的體積分數為;容器的容積為。組卷:69引用:17難度:0.5


