2021-2022學年江蘇省南通市海安市某中學高三(上)第一次段考化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.2021年6月,中國航天員搭乘“神舟十二號”進駐空間站,開啟了中華民族“空間站時代”的新篇章。下列說法不正確的是( )
A.艙外航天服使用的鍍鋁膠布是一種復合材料 B.航天器使用的太陽能電池板的主要成分是二氧化硅 C.航天員“天地通話”耳機使用的雙層蛋白皮革是有機物 D.航天員佩戴的質輕、耐沖擊腕表使用的鈦合金是金屬材料 組卷:17引用:5難度:0.6 -
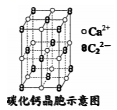 2.實驗室用電石(主要成分為碳化鈣)與水反應制取乙炔。乙炔中混有的H2S氣體可用CuSO4溶液吸收,反應方程式為H2S+CuSO4═CuS↓+H2SO4。下列說法正確的是( )
2.實驗室用電石(主要成分為碳化鈣)與水反應制取乙炔。乙炔中混有的H2S氣體可用CuSO4溶液吸收,反應方程式為H2S+CuSO4═CuS↓+H2SO4。下列說法正確的是( )A.由圖可知,碳化鈣的化學式為CaC2 B.乙炔分子中σ鍵和π鍵數目相等 C.H2S是非極性分子 D.H2SO4屬于離子化合物 組卷:39引用:3難度:0.6 -
3.如圖利用海帶提取單質碘的實驗原理與裝置不能達到實驗目的的是( )
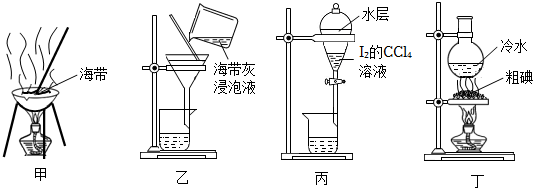
A.用裝置甲灼燒海帶 B.用裝置乙過濾海帶灰浸泡液 C.用裝置丙得到I2的CCl4溶液 D.用裝置丁提純粗碘 組卷:121引用:13難度:0.5 -
4.氮、磷、砷元素廣泛應用于生產生活中,NH3、N2H4(肼)、NO、NO2、HNO3等是氮重要的無機化合物,下列氮及其化合物的性質與用途的對應關系不正確的是( )
A.硫酸銨溶液水解顯酸性,可用作除銹劑 B.液氨易氣化,可用作致冷劑 C.氮氣的化學性質穩定,部分地區儲藏蔬菜和水果常充氮氣來防氧化 D.常溫下濃硝酸與鐵或鋁發生鈍化,因此不能用鐵制或鋁制容器裝濃硝酸 組卷:26引用:1難度:0.7 -
5.NO2與N2O4能相互轉化,熱化學方程式為N2O4(g)?2NO2(g)ΔH=+57kJ?mol-1,下列有關說法正確的是( )
A.降低體系溫度逆反應速率減小,正反應速率增大 B.若容器體積不變,氣體顏色不變時說明該反應未建立化學平衡 C.其他條件不變,向平衡后的容器中再加入少量N2O4,新平衡 的值不變c2(NO2)c(N2O4)D.減小體系的壓強能降低N2O4的反應速率和轉化率 組卷:28引用:6難度:0.6
二、非選擇題:共4題,共58分。
-
 17.LiFePO4電極材料是動力型鋰離子電池的理想正極材料。
17.LiFePO4電極材料是動力型鋰離子電池的理想正極材料。
(1)以LiOH、FeSO4、H3PO4和葡萄糖為原料,利用如圖所示裝置(固定裝置已略去)制取LiFePO4/C電極的過程如下:
步驟1:準確稱量18.00 g LiOH、38.00 g FeSO4和75 mL H3PO4溶液(含溶質24.50 g)。
步驟2:將LiOH置于三頸燒瓶中,加入煮沸過的蒸餾水,攪拌使其溶解。從分液漏斗中滴加H3PO4溶液,實驗過程中不斷通入氮氣,直至H3PO4滴加完畢。
步驟3:將FeSO4固體溶于蒸餾水中,迅速倒入三頸燒瓶中,快速攪拌,充分反應后,過濾并洗滌沉淀得LiFePO4固體。
步驟4:將LiFePO4與一定量葡萄糖混合,惰性氣氛下加熱,得到LiFePO4/C。
①步驟2向三頸燒瓶中通入N2的目的是,該步驟中為達到相同目的采取的措施還有。
②步驟3發生反應的化學方程式為。
(2)已知:Li2CO3微溶于水;LiFePO4、FePO4難溶于水和堿,可溶于鹽酸生成LiCl、FeCl2、FeCl3和H3PO4;pH>3.2時,Fe3+沉淀完全。完善由某廢舊電極材料(含鋁、炭、LiFePO4和FePO4)制取Li2CO3的實驗方案:邊攪拌邊向廢舊電極材料中加入NaOH溶液至不再產生氣泡,過濾,,過濾、洗滌,低溫干燥得Li2CO3固體。(實驗中須使用的試劑有:雙氧水、鹽酸、NaOH溶液、Na2CO3溶液)
(3)磷精鐵渣(FexP)可作為制取LiFePO4的原料。一種測定FexP組成的實驗方法如下:準確稱取1.840 g磷精鐵渣于燒杯中,加入過量硝酸和硫酸的混合溶液,加熱,使磷鐵渣充分溶解。過濾,將濾液配成100 mL溶液A。取20.00 mL溶液A,加入100 mL 0.06000 mol?L?1 EDTA標準溶液,加入氨水調節pH約為2,加熱使之充分反應。冷卻,加入指示劑,用0.05000 mol?L?1 Bi3+標準溶液滴定過量的EDTA,消耗Bi3+標準溶液24.00 mL。通過計算確定FexP的化學式(寫出計算過程)。已知:EDTA與Fe3+和Bi3+反應的化學計量數之比均為1:1。組卷:13引用:2難度:0.4 -
18.二氧化氯(ClO2)是一種重要的氧化劑,可用于某些污染物的處理。
(1)ClO2可由圖1所示裝置制備(電極不反應)。
①電解時陽極附近溶液的pH(填“減小”“增大”或“不變”)。
②陰極上產生ClO2的機理如圖2所示(A、B均為含氯微粒,其他微粒未標出)。該機理可描述為。
(2)ClO2可用于水體中Mn2+的去除。控制其他條件不變,在水體pH分別為7.1、7.6、8.3時,測得Mn2+濃度隨反應時間的變化如圖3所示。
①pH=8.3時水體中Mn2+轉化為MnO2,ClO2轉化為ClO2-,該反應的離子方程式為。
②反應相同時間,水體中Mn2+濃度隨pH增大而降低的原因是。
(3)ClO2可對煙氣中NOx、SO2進行協同脫除,涉及的部分反應如下:
Ⅰ.ClO2+NO═NO2+ClO
Ⅱ.ClO+NO═Cl+NO2
Ⅲ.ClO2+SO2═ClO+SO3
Ⅳ.ClO+SO2═Cl+SO3
反應Ⅳ的歷程如圖4所示。該歷程中最大活化能E正=kJ?mol-1。組卷:24引用:1難度:0.6


