2021-2022學年廣東省東莞市七校高二(下)期中化學試卷
發布:2024/11/10 15:30:2
一、選擇題(只有一個答案符合要求,1-10題每題2分,11-16題每題4分,共44分)
-
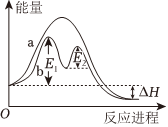 1.某反應過程的能量變化如圖所示,下列說法錯誤的是( )
1.某反應過程的能量變化如圖所示,下列說法錯誤的是( )A.相比反應過程a,過程b可能有催化劑參與 B.該反應為△H<0 C.工業生產上使用催化劑可以降低生產能耗 D.反應過程 b的活化能為 E1+E2 組卷:10引用:1難度:0.4 -
2.2月24日,俄烏戰爭爆發,烏方違反《第三議定書》明令禁止使用黃磷彈。黃磷(化學式為P4)、紅磷(化學式為P)燃燒的熱化學方程式(0℃,101kPa)分別為:P4(s)+5O2(g)=P4O10(s)ΔH=-3093.2kJ?mol-1;4P(s)+5O2(g)=P4O10(s)ΔH=-2954.0kJ?mol-1。由此判斷下列說法正確的是( )
A.紅磷的燃燒熱為2954.0kJ?mol-1 B.已知黃磷分子為正四面體結構,則 P-P鍵之間的夾角為109°28′ C.由紅磷轉化為黃磷是吸熱反應,等質量時黃磷能量比紅磷高 D.等質量的黃磷和紅磷在相同條件下分別與足量氯氣反應,設產物只有PCl5,則紅磷放出的熱量更多 組卷:8引用:1難度:0.7 -
3.某科研人員提出HCHO與O2在羥基磷灰石(HAP)表面催化氧化生成CO2、H2O的歷程,該歷程示意圖如圖(圖中只畫出了HAP的部分結構)。下列說法不正確的是( )

A.HAP能提高HCHO與O2的反應速率 B.HCHO在反應過程中,有C-H鍵發生斷裂 C.根據圖示信息,CO2分子中的氧原子全部來自O2 D.該反應可表示為:HCHO+O2 CO2+H2OHAP組卷:270引用:52難度:0.7 -
4.下列說法正確的是( )
A.酸堿中和滴定接近終點時,滴定管的尖端可以接觸錐形瓶內壁 B.工業上合成NH3常選擇500℃時進行而不是常溫,是基于勒夏特列原理考慮的 C.中和熱測定:用50mL0.50mol/L鹽酸和50mL0.55mol/LNaOH溶液進行實驗,用量筒量取NaOH溶液時,仰視取液,測得的中和熱ΔH偏小 D.中科院耗時20年自研新型涂層和陰極保護聯合防護技術在港珠澳大橋派上了用場,其中陰極保護技術與犧牲陽極的陰極保護法原理完全不同 組卷:6引用:1難度:0.4 -
5.設NA為阿伏加德羅常數的數值,下列說法正確的是( )
A.將NA個N2和3NA個H2置于密閉的容器中充分反應生成NH3(g),放熱38.6kJ,則熱化學方程式為:N2(g)+3H2(g)?2NH3(g)ΔH=-38.6kJ?mol-1 B.1L0.1mol/LCH3COOH溶液中含有的氫原子數大于0.4NA C.將25gCuSO4?5H2O溶于水配成1L溶液,則溶液中Cu2+數目為0.1NA D.將NA個CO2分子通入1L1mol/L的NaOH中,充分反應后溶液中存在守恒式:c(OH-)=c(H+)+c( )+2c(H2CO3)HCO-3組卷:7引用:1難度:0.5 -
 6.室溫下,濃度均為0.2mol?L-1的HA和BOH溶液等體積混合后,所得溶液中部分粒子組分及濃度如圖所示。下列說法中不正確的是( )
6.室溫下,濃度均為0.2mol?L-1的HA和BOH溶液等體積混合后,所得溶液中部分粒子組分及濃度如圖所示。下列說法中不正確的是( )A.HA、BOH均為弱電解質 B.X表示HA或BOH分子 C.電離常數K(HA)=K(BOH) D.該鹽溶液pH=4 組卷:1引用:1難度:0.4
二、填空題(4題,共56分)
-
19.大氣環境中NOx的減量化排放受到國內外的廣泛關注。利用碳還原NO的反應為:C(s)+2NO(g)?N2(g)+CO2(g)ΔS較小。回答下列問題:

(1)該反應在常溫下可以自發進行,則反應的ΔH0(填“>”“=”或“<”),有利于提高NO平衡轉化率的條件是(任寫一條)。平衡后,若保持溫度和容積不變,向體系中加入少量NO,NO的平衡轉化率(填“增大”、“減小”或“不變”)。
(2)以上反應可分為如下四步反應歷程,寫出其中第三步的反應:
第一步:2NO=(NO)2
第二步:C+(NO)2=C(O)+N2O
第三步:
第四步:2C(O)=CO2+C
(3)對比研究活性炭負載銅、鑭的反應活性。在三個反應容器中分別加入La/C、Cu/C、C,通入NO使其濃度達到相同濃度。不同溫度下,測得第3小時末(未到達平衡)NO去除率如圖所示:
①恒溫恒容下C(s)+2NO(g)?N2(g)+CO2(g)下列能說明反應達平衡狀態的是。
A.總壓強恒定不變
B.氣體的平均相對分子質量不再改變
C.氣體的平均密度不再改變
D.Cu/C催化、200℃時NO去除率達50%
②據圖分析,相同溫度下La/C、Cu/C去除NO效果比C更好,可能的原因是(寫一條)。
③上述實驗中,200℃時,若測得NO的去除率為80%,則可能采取的措施是。
A.及時分離出CO2
B.壓縮體積
C.恒容下,向體系中通入氮氣
D.尋找更好的催化劑組卷:1引用:1難度:0.7 -
20.Ⅰ.丙烯(C3H6)是重要的有機化工原料。丙烷脫氫制丙烯發生的主要反應及能量變化如圖1。

(1)丙烷脫氫制丙烯的過程中。恒壓時向原料氣中摻入高溫水蒸氣,則K(主反應)(填“增大”、“減小”或“不變”,下同),轉化率α(C3H8)。溫度升高,副反應更容易發生的主要原因是。
(2)先以丙烯制丙烯腈,再用丙烯腈在陰極電合成已二腈(弱酸環境),總反應式:2CH2=CH-CN+H2O=NC(CH2)4CN+O2↑,則陽極電極反應式:12。
Ⅱ.在2.0L密閉容器中,通入0.10molCH4和0.20molNO2進行反應:CH4(g)+2NO2(g)?CO2(g)+N2(g)+2H2O(g)ΔH<0,溫度為T1和T2下,反應時間(t)與容器內甲烷物質的量數據見下表:
(3)計算T1、0~2min內NO2的平均反應速率v(NO2)=時間(t/min) 0 2 4 6 10 12 T1,甲烷物質的量 0.10 0.082 0.068 0.060 0.045 0.045 T2,甲烷物質的量 0.10 0.080 0.065 0.055 0.050 - mol?L-1?min-1,溫度T2下的平衡常數K=mol?L-1(若提供的數據不足以計算,填“無法確定”)。
(4)在一恒容密閉容器中,通入一定量CH4和NO2,測得在相同時間內,不同溫度下,NO2的轉化率隨溫度的變化如圖2。c點(填“是”或“不是”)反應達平衡的點。 組卷:2引用:1難度:0.6
組卷:2引用:1難度:0.6


