2020-2021學(xué)年湖南省邵陽(yáng)市文德高級(jí)中學(xué)高二(下)期中化學(xué)試卷
發(fā)布:2024/12/15 10:0:2
一、單選題(每小題3分,共30分)
-
1.已知:H2(g)+
O2(g)═H2O(g)△H1=-241.8kJ?mol-1,C(s)+12O2(g)═CO(g)△H2=-110.5kJ?mol-1.由此可知焦炭與水蒸氣反應(yīng)的熱化學(xué)方程式為:C(s)+H2O(g)═CO(g)+H2(g)△H3,則△H3為( )12A.+131.3 kJ?mol-1 B.-131.3 kJ?mol-1 C.+352.3 kJ?mol-1 D.-352.3 kJ?mol-1 組卷:101引用:5難度:0.9 -
2.已知反應(yīng)4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在不同條件下的化學(xué)反應(yīng)速率如下,其中反應(yīng)速率最快的是( )
A.v(NH3)=0.2mol?L-1?s-1 B.v(O2)=4.0mol?L-1?min-1 C.v(NO)=1.2mol?L-1?min-1 D.v(H2O)=0.25mol?L-1?s-1 組卷:25引用:4難度:0.7 -
3.下列關(guān)于反應(yīng)能量的說(shuō)法正確的是( )
A.已知:I2(g)+H2(g)?2HI(g)△H=-9.48kJ?mol-1。若將1mol I2(g)和1mol H2(g)置于密閉容器中充分反應(yīng)后,放出熱量為9.48kJ B.已知:H2的燃燒熱為285.8kJ?mol-1。表示氫氣燃燒熱的熱化學(xué)方程式為2H2(g)+O2(g)═2H2O(l)ΔH=-571.6kJ?mol-1 C.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點(diǎn)燃條件下的ΔH不同 D.已知中和熱為57.3kJ?mol-1。CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)ΔH>-57.3kJ?mol-1 組卷:14引用:2難度:0.5 -
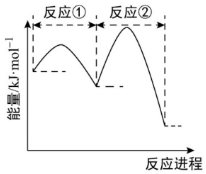 4.已知NO和O2經(jīng)反應(yīng)①和反應(yīng)②轉(zhuǎn)化為NO2,其能量變化隨反應(yīng)進(jìn)程的圖示如下。
4.已知NO和O2經(jīng)反應(yīng)①和反應(yīng)②轉(zhuǎn)化為NO2,其能量變化隨反應(yīng)進(jìn)程的圖示如下。
①2NO(g)?N2O2(g)△H1平衡常數(shù)K1
②N2O2(g)+O2(g)?2NO2(B)△H2平衡常數(shù)K2
下列說(shuō)法不正確的是( )A.△H1<0,△H2<0 B.2NO(g)+O2(g)?2NO2(g)的平衡常數(shù)K= K1K2C.表示2NO(g)+O2(g)?2NO2(g)的△H=△H1+△H2 D.反應(yīng)②的速率大小決定2NO(g)+O2(g)?2NO2(g)的反應(yīng)速率 組卷:82引用:7難度:0.5 -
5.下列反應(yīng)既屬于非氧化還原反應(yīng),又屬于吸熱反應(yīng)的是( )
A.干冰升華 B.灼熱的炭與CO2的反應(yīng) C.鐵片與稀鹽酸的反應(yīng) D.Ba(OH)2?8H2O與NH4Cl的反應(yīng) 組卷:9引用:6難度:0.6 -
6.在1200℃時(shí),天然氣脫硫工藝中會(huì)發(fā)生下列反應(yīng):
①H2S(g)+O2(g)═SO2(g)+H2O(g)△H132
②2H2S(g)+SO2(g)═S2(g)+2H2O(g)△H232
③H2S(g)+O2(g)═S(g)+H2O(g)△H312
④2S(g)═S2(g)△H4
則△H4的正確表達(dá)式為( )A.△H4= (△H1+△H2-3△H3)32B.△H4= (3△H3-△H1-△H2)32C.△H4= (△H1-△H2-3△H3)32D.△H4= (△H1+△H2-3△H3)23組卷:27引用:2難度:0.6
三、填空題
-
19.已知可逆反應(yīng)A(g)?B(g)的正、逆反應(yīng)均為一級(jí)反應(yīng),v正=k正?c(A),v逆=k逆?c(B)且存在如表數(shù)據(jù):
600k時(shí),在容積為1L的恒容密閉容器中充入2mol氣體A,已知反應(yīng)過(guò)程中物質(zhì)的濃度、速率常數(shù)和反應(yīng)時(shí)間之間滿足如下關(guān)系:2.3lg溫度(k) 600 850 速率
常數(shù)k正(min-1) 32 70 k逆(min-1) 8 12 ═(k正+k逆)t,[c0(A)為反應(yīng)物A的起始濃度,ct(A)、ct(B)分別為A,B任意時(shí)刻的濃度,k為反應(yīng)速率常數(shù),t為反應(yīng)時(shí)間],則:k正c0(A)k正ct(A)+k逆ct(B)
①t=min時(shí)反應(yīng)達(dá)平衡。
②反應(yīng)一段時(shí)間后A,B濃度相等,則這段時(shí)間內(nèi)正反應(yīng)的平均反應(yīng)速率v=mol(L?min)(保留整數(shù))。(已知lg2=0.3,lg5=0.7)組卷:7引用:3難度:0.5 -
20.工業(yè)上,裂解丁烷可以獲得乙烯、丙烯等化工原料.
反應(yīng)1:C4H10(g,正丁烷)?CH4(g)+C3H6(g)△H1
反應(yīng)2:C4H10(g,正丁烷)?C2H6(g)+C2H4(g)△H2
已知幾種烴的燃燒熱如下:
回答下列問(wèn)題:烴 正丁烷 異丁烷 甲烷 乙烷 乙烯 丙烯 燃燒熱(△H)/(kJ?mol-1) -2878 -2869 -890.3 -1559.8 -1411 -2058.3
(1)根據(jù)上述數(shù)據(jù)計(jì)算,ΔH1=kJ?mol-1.
(2)穩(wěn)定性:正丁烷異丁烷(填“大于”“小于”或“等于”).
(3)在密閉容器中投入一定量的正丁烷,發(fā)生上述反應(yīng)1和2,測(cè)定丁烷的平衡轉(zhuǎn)化率(α)與壓強(qiáng)(p)、溫度(T)關(guān)系如圖所示.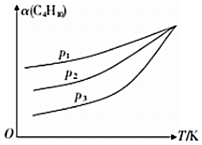
①在相同壓強(qiáng)下,升高溫度,丁烷的平衡轉(zhuǎn)化率增大的原因是.
②比較壓強(qiáng)大小:p1p2p3(填“>”“<”或“=”).
(4)某溫度下,向2L恒容密閉容器中投入2mol正丁烷.假設(shè)控制反應(yīng)條件,只發(fā)生反應(yīng)1,達(dá)到平衡時(shí)測(cè)得CH4的體積分?jǐn)?shù)為.13
①下列情況表明上述反應(yīng)達(dá)到平衡的是(填字母,雙選).
A.混合氣體的密度保持不變
B.甲烷、丙烯的生成速率相等
C.混合氣體壓強(qiáng)保持不變
D.丙烯體積分?jǐn)?shù)保持不變
②該溫度下,反應(yīng)1的平衡常數(shù)K=.組卷:20引用:3難度:0.6


