2019-2020學年四川省眉山市仁壽一中南校區高一(下)開學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共26小題,每小題2分,滿分52分)
-
1.以下非金屬氧化物與其引起的環境問題及主要來源對應正確的是( )
氧化物 環境問題 主要來源 A CO2 酸雨 化石燃料的燃燒 B CO CO中毒 汽車尾氣和化石燃料的不完全燃燒 C NO2 溫室效應 工廠廢氣的排放 D SO2 光化學煙霧 汽車尾氣的排放 A.A B.B C.C D.D 組卷:93引用:31難度:0.9 -
2.下列物質可用來區別SO2和CO2氣體可選用( )
A.澄清石灰水 B.品紅溶液 C.帶火星的木條 D.石蕊試液 組卷:30引用:2難度:0.6 -
3.下列物質中可用來干燥NH3的是( )
A.濃H2SO4 B.堿石灰 C.P2O5 D.無水CaCl2 組卷:25引用:3難度:0.9 -
4.現有下列物質,其中必須保存在棕色瓶里的是( )
①氯水 ②氨水 ③濃硝酸 ④硝酸銀 ⑤燒堿.A.①②③ B.①③④ C.①③ D.②⑤ 組卷:36引用:6難度:0.9 -
5.下列關于濃硝酸和濃硫酸的敘述,正確的是( )
A.常溫下都用銅容器貯存 B.露置在空氣中,容器內酸液的質量都減輕 C.常溫下都能與銅較快反應 D.露置在空氣中,容器內酸液的濃度都降低 組卷:95引用:11難度:0.9 -
6.已知a為IIA族元素,b為ⅢA族元素,它們的原子序數分別為m和n,且A.b為同一周期元素,下列關系式錯誤的是( )
A.n=m+11 B.n=m+25 C.n=m+10 D.n=m+1 組卷:108引用:26難度:0.7 -
7.二氧化硫和氯氣都有漂白性,現把二者以等物質的量混合,讓混合氣體通入品紅溶液,則其漂白性將( )
A.和氯氣單獨通過時相同 B.和二氧化硫單獨通過時相同 C.是二者作用效果之和 D.失去漂白性 組卷:21引用:3難度:0.9 -
8.用下列實驗裝置進行的實驗,能達到相應實驗目的是( )
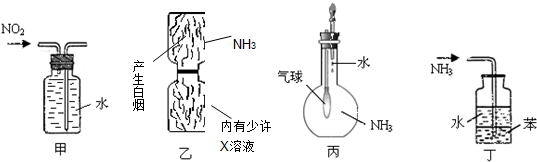
A.裝置甲:收集NO2氣體 B.裝置乙:驗證X溶液為濃硫酸 C.裝置丙:驗證氨氣在水中的溶解性 D.裝置丁:用于吸收尾氣NH3 組卷:21引用:11難度:0.9 -
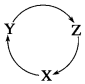 9.下列各組物質中,滿足圖物質一步轉化關系的選項是( )
9.下列各組物質中,滿足圖物質一步轉化關系的選項是( )選項 X Y Z A Na NaOH NaHCO3 B Cu CuSO4 CuS C C CO2 CO D Si SiO2 H2SiO3 A.A B.B C.C D.D 組卷:16引用:1難度:0.7 -
10.試判斷114號元素應位于周期表中的( )
A.第六周期,第ⅣA族 B.第七周期,第ⅣA族 C.第七周期,第ⅦA族 D.第八周期,第ⅥA族 組卷:57引用:1難度:0.7
二、解答題(共4小題,滿分48分)
-
 29.如圖為我國新疆阿勒泰大氣背景監測點。
29.如圖為我國新疆阿勒泰大氣背景監測點。
監測點安裝的監測設備可日常監測二氧化硫、二氧化氮、一氧化氮及臭氧等污染物。NO分子因污染空氣而臭名昭著,近年來,發現少量的NO在生物體內許多組織中存在,它有擴張血管、免疫、增強記憶的功能,而成為當前生命科學的研究熱點,NO亦被稱為“明星分子”。請回答下列問題。
(1)NO的危害在于(填編號)。
A.破壞臭氧層 B.高溫下能使一些金屬氧化
C.造成酸雨 D.與人體血紅蛋白結合
(2)汽車尾氣中含有NO和CO,消除這兩種物質對大氣的污染,通常采用的方法是安裝催化轉化器,使他們發生化學反應轉化成無毒氣體,則該反應的化學反應方程式為。
(3)氟利昂(如CCl2F2)可在光合作用下分解,產生氯原子,氯原子會對臭氧層產生長久的破壞作用(臭氧的分子式為O3)。有關反應如下:Cl+O3→ClO+O2;ClO+O→Cl+O2;總反應:2O3→3O2.在上述臭氧變成氧氣的反應過程中,Cl是。
(4)氮氧化物(如NO2、NO等)進入大氣后,不僅會形成硝酸型酸雨,還可能形成光化學煙霧。因此必須對含有氮氧化物的廢氣進行處理。用氫氧化鈉溶液可吸收廢氣中的氮氧化物。反應的化學方程式如下:NO2+NO+2NaOH═2NaNO2+H2O ①2NO2+2NaOH═NaNO2+NaNO3+H2O ②將336mLNO、112mLNO2和112mLN2O4的混合氣體(體積均折算成標準狀況的氣體體積)緩緩通入盛有0.3mol/L NaOH溶液的燒杯中,氣體恰好被完全吸收,則至少需要NaOH溶液的體積為。
(5)氨氣(NH3)也可用來處理氮氧化物。例如,氨氣與二氧化氮反應:8NH3+6NO2=7N2+12H2O。
若某工廠排出廢氣中NO2含量為0.5%(體積分數),則處理1.0×103 m3(標準狀況)這種廢氣,需要千克氨氣(計算結果保留2位小數)。組卷:13引用:1難度:0.6 -
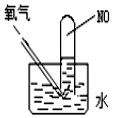 30.回答下列問題:
30.回答下列問題:
(1)將等質量的鎂分別與足量的CO2、O2、N2、空氣中充分燃燒,反應前后固體增重由大到小的順序為。
(2)在常溫下,實驗室用固體亞硫酸鈉和中等濃度的硫酸制取SO2氣體。將制得的SO2氣體通入紫色石蕊試液,可觀察到的現象為。
(3)在常溫下,把NO氣體壓縮到1.01×108 Pa,在一個體積固定的容器里加熱到50℃,發現氣體的壓力迅速下降,壓力降至略小于原壓力2/3就不再改變,已知其中一種產物為N2O,寫出上述變化的化學方程式。
(4)按圖進行實驗,試管中裝有NO,然后緩慢地通入84mLO2,充分反應后液面高度不變,則原試管中裝有NO的體積為。
(5)標況下,將一定體積的盛滿NO、NO2、O2的混合氣體的試管倒立于水槽中,水充滿整個試管,則試管內的溶液的物質的量濃度范圍是(假定試管內溶液不擴散)為。組卷:34引用:2難度:0.5


