2021-2022學年山東省泰安市肥城市高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題意。
-
1.能量通常包括熱能、電能、光能、機械能、化學能等,下列有關能量轉化關系的判斷錯誤的是( )
A.甲烷燃燒:化學能轉化為熱能和光能 B.植物進行光合作用:太陽能轉化為化學能 C.二次電池放電:電能轉化為化學能 D.風力發電:風能轉化為機械能,機械能轉化為電能 組卷:63引用:8難度:0.7 -
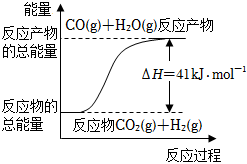 2.根據如圖所示情況,判斷下列說法中正確的是( )
2.根據如圖所示情況,判斷下列說法中正確的是( )A.其熱化學方程式為CO(g)+H2O(g)═CO2(g)+H2(g)ΔH=41kJ?mol-1 B.該反應為吸熱反應 C.1molCO具有的能量比1molCO2具有的能量高 D.當H2O為液態時,其反應熱大于41kJ?mol-1 組卷:63引用:2難度:0.7 -
3.用鐵片與稀硫酸反應制取氫氣時,下列措施不能使氫氣生成速率加大的是( )
A.加熱 B.稀硫酸改用98%的濃硫酸 C.滴加少量CuSO4溶液 D.鐵片改用鐵粉 組卷:14引用:5難度:0.5 -
4.自嗨鍋的發熱包主要成分有:硅藻土、鐵粉、鋁粉、焦炭粉、鹽、生石灰,使用時使發熱包里面的物質與水接觸即可。下列說法錯誤的是( )
A.鐵粉發生析氫腐蝕,緩慢放出熱量,延長放熱時間 B.硅藻土可增大反應物的接觸面積 C.主要反應物為生石灰,與水反應放熱 D.使用后的發熱包屬于有害垃圾 組卷:75引用:3難度:0.3 -
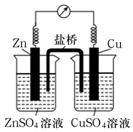 5.某銅鋅原電池的結構如圖所示,下列說法正確的是( )
5.某銅鋅原電池的結構如圖所示,下列說法正確的是( )A.Zn電極為該原電池的正極 B.電池工作時,電子由Zn電極流出,經溶液和鹽橋流入Cu電極 C.Cu電極上的電極反應式為Cu-2e-═Cu2+ D.若鹽橋中的電解質為KCl,則電池工作時K+向右側移動 組卷:31引用:2難度:0.6 -
6.下列說法不正確的是( )
A.工業合成氨中,升溫有利于提高反應速率和原料平衡轉化率 B.對于任何化學反應來說,反應速率加快,反應進行的程度不一定增大 C.平衡移動,平衡常數不一定改變;平衡常數改變,平衡一定移動 D.化學平衡正向移動,正反應速率不一定增大 組卷:6引用:1難度:0.6
三、非選擇題:本題共5小題,共60分。
-
19.某研究性學習小組利用H2C2O4與酸性KMnO4溶液的反應,探究“外界條件對化學反應速率的影響”,實驗記錄如表所示:
查閱資料:KMnO4溶液中滴加過量的H2C2O4,振蕩后溶液由紫色變為無色,反應的離子方程式為:5H2C2O4+2MnO4-+6H+═2Mn2++10CO2↑+8H2O。實驗組別 實驗溫度/K 參加反應的物質 溶液褪色所需時間/s KMnO4溶液(含硫酸) H2C2O4溶液 H2O V/mL c/mol?L-1 V/mL c/mol?L-1 V/mL A 293 3 0.2 7 1 0 60 B T 1 3 0.2 5 1 V 1 80 C 313 3 0.2 V 2 1 2 t 1
回答下列問題:
(1)T1=。
(2)V1=,理由是。
(3)若探究溫度對化學反應速率的影響,可選擇實驗(填組別),根據實驗數據,可以得出的結論是。
(4)甲同學依據經驗繪制出A組實驗中V(CO2)隨時間t的變化如圖1所示,乙同學查閱資料發現實驗過程中V(CO2)隨時間t的變化趨勢如圖2所示。
小組同學針對這一現象,設計實驗進一步探究影響因素,具體情況見如表。
①補全方案1中的實驗操作:方案 假設 實驗操作 1 該反應放熱,使溶液溫度升高,化學反應速率提高 向燒杯中加入3mL0.2mol?L-1 KMnO4溶液和7mL1mol?L-1 H2C2O4溶液, 。2 取3mL0.2mol?L-1KMnO4溶液加入燒杯中,向其中加入少量硫酸錳固體,再加入7mL1mol?L-1H2C2O4溶液 ;②方案2中的假設為。組卷:8引用:1難度:0.6 -
20.電化學知識在物質制備領域的應用前景看好。
(1)氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品。如圖是離子交換膜法電解食鹽水的示意圖,圖中的離子交換膜只允許陽離子通過。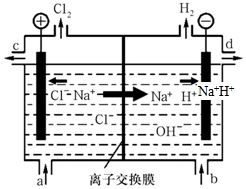
①電解飽和食鹽水的化學方程式為;
②氫氧化鈉溶液從圖中(填“a”“b”“c”或“d”,下同)處收集;
③當有1molNa+通過離子交換模時,產生氯氣的體積(標準狀況下)是。
(2)按如圖1所示裝置進行電解,A、B、C、D均為鉑電極,回答下列問題。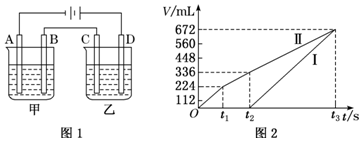
已知一:甲槽電解的是200 mL一定濃度的NaCl與CuSO4的混合溶液,理論上兩極所得氣體體積隨時間變化的關系如圖2所示(氣體體積已換算成標準狀況下的體積,電解前后溶液的體積變化忽略不計)。
①原混合溶液中NaCl的物質的量濃度為mol?L-1,CuSO4的物質的量濃度為mol?L-1。
已知二:乙槽為200 mL CuSO4溶液。
②當C極析出0.64g物質時,乙槽溶液中生成的H2SO4為mol。電解后,若使乙槽內的溶液完全復原,可向乙槽中加入(填序號)。
A.Cu(OH)2
B.CuO
C.CuCO3
D.Cu2(OH)2CO3
③若通電一段時間后,向所得的乙槽溶液中加入0.2mol的Cu(OH)2才能恰好恢復到電解前的濃度,則電解過程中轉移的電子數為(用NA表示阿伏加德羅常數)。組卷:26引用:1難度:0.5


