2022-2023學年江蘇省蘇州市常熟市高三(上)段考化學試卷
發布:2024/9/12 8:0:9
一、單項選擇題:每小題3分,共計42分。每小題只有一個選項最符合題意。
-
1.油紙傘是國家級非物質文化遺產之一,《天工開物》中寫道“凡糊雨傘與油扇,皆用小皮紙”,這里的皮紙主要是指桑皮和山椏皮。通常油紙傘的制作工藝主要經歷備料、制傘骨架、制傘面、傘面繪圖、裝飾等幾個步驟。下列有關說法中正確的是( )
A.桑皮和山椏皮主要成分為蛋白質 B.桐油由桐樹種子壓榨而得,屬于油脂 C.繪圖顏料石綠——孔雀石主要成分堿式碳酸銅為復鹽 D.桐油在空氣中發生物理變化變稠變干 組卷:147引用:3難度:0.3 -
2.Be2+和Al3+的電荷與半徑之比相近,導致兩元素性質相似。下列說法錯誤的是( )
A.Be2+與Al3+都能在水中與氨形成配合物 B.BeCl2和AlCl3的熔點都比MgCl2的低 C.Be(OH)2和Al(OH)3均可表現出弱酸性 D.Be和Al的氫化物都不能在酸中穩定存在 組卷:335引用:5難度:0.6 -
3.下列物質的性質與應用對應關系正確的是( )
A.聚合硫酸鐵能水解并形成膠體,可用于自來水的殺菌消毒 B.Na2O2具有強氧化性,可用作呼吸面具供氧劑 C.氧化鋁熔點很高,可用于制造耐火坩堝 D.SiO2硬度大,可用于制光導纖維 組卷:19引用:4難度:0.7 -
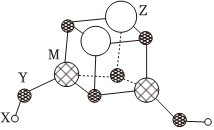 4.短周期元素X、Y、Z、M的原子序數依次增大,他們組成一種團簇分子,結構如圖所示。X、M的族序數等于周期數,Y是地殼中最豐富、分布最廣的元素,Z原子最外層電子數為2。下列說法不正確的是( )
4.短周期元素X、Y、Z、M的原子序數依次增大,他們組成一種團簇分子,結構如圖所示。X、M的族序數等于周期數,Y是地殼中最豐富、分布最廣的元素,Z原子最外層電子數為2。下列說法不正確的是( )A.該團簇分子的分子式為 X2Z2M2Y6 B.簡單離子半徑:Y>M C.工業上常電解熔融的ZY制取Z單質 D.第一電離能:M<Z 組卷:27引用:3難度:0.5 -
5.在指定條件下,下列選項所示的物質間的轉化能夠實現的是( )
A.SO2 H2SO4H2OB.濃H2SO4 SO2S△C.S SO3O2點燃D.SO3 Br2HBr組卷:5引用:1難度:0.7 -
6.下列實驗裝置(部分夾持裝置略)或現象錯誤的是( )
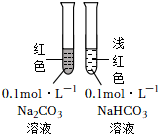
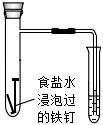
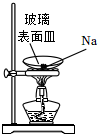
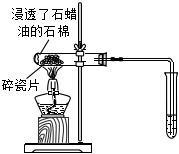
A.滴入酚酞溶液 B.吸氧腐蝕 C.鈉的燃燒 D.石蠟油的熱分解 A.A B.B C.C D.D 組卷:464引用:5難度:0.7
二、非選擇題(共4題,共58分)
-
17.硫氰化鉀(KSCN)是一種用途廣泛的化學藥品KSCN熔點為172℃,加熱至430℃會發生變化,500℃時發生分解。實驗室制備硫氰化鉀的裝置如圖所示:
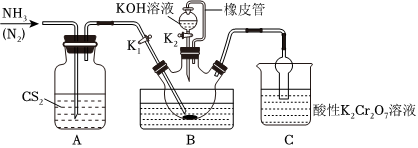
已知:Ⅰ.NH3不溶于CS2,CS2密度比水大且不溶于水;
Ⅱ.三頸瓶內盛放:CS2、水和催化劑;
Ⅲ.CS2+3NH3NH4SCN+NH4HS,該反應比較緩慢且NH4SCN在高于170℃時易分解。催化劑水浴加熱
(1)制備KSCN溶液
①A裝置的作用是。
②實驗過程中待觀察到三頸燒瓶中出現現象時,關閉K1,保持三頸燒瓶內液溫105℃一段時間,然后打開K2,繼續保持液溫105℃一段時間,緩緩滴入適量的KOH溶液,充分反應。打開K2,繼續保持液溫105℃一段時間的原因是。寫出三頸燒瓶中生成KSCN的化學方程式。
③得到硫氰化鉀晶體:、、、過濾,洗滌,減壓干燥,得硫氰化鉀晶體。
(2)性質探究
在試管中依次加入1滴0.2mol?L-1(NH4)2Fe(SO4)2溶液、5mL飽和碘水、1滴0.1mol?L-1AgNO3溶液,tmin后加入1滴KSCN溶液,溶液變紅。甲同學認為是I2氧化了Fe2+,乙同學提出了質疑,認為實驗現象不能證明I2氧化了Fe2+,可能是AgNO3氧化了Fe2+。請設計實驗方案驗證乙同學的質疑。
(3)題中涉及的(NH4)2Fe(SO4)2溶液是由(NH4)2Fe(SO4)2?6H2O溶于水得到,實驗室常用(NH4)2Fe(SO4)2?6H2O標準溶液測定過二硫酸銨[(NH4)2S2O8]的純度(過二硫酸銨的相對分子量為238,滴定反應的離子方程式為:S2+2Fe2+═2Fe3++2O2-8)。取wg過二硫酸銨樣品溶于蒸餾水配制成250mL溶液。準確量取20.00mL配制的溶液于錐形瓶中,用cmol?L-1(NH4)2Fe(SO4)2標準溶液滴定至終點,重復進行三次平行實驗,測得有關數據如表所示:SO2-4
根據上述數據計算,樣品的純度為實驗序號 起始讀數/mL 終點讀數/mL Ⅰ 2.50 22.58 Ⅱ 1.00 23.12 Ⅲ 0.00 19.92 (用含w、c的代數式表示,可不化簡)。組卷:4引用:2難度:0.5 -
18.鈷(27Co)的常見化合價有+2、+3等,均容易形成相應配離子,如[Co(NH3)6]2+、[Co(NH3)6]3+。[Co(NH3)6]2+,脫除煙氣中NO的機理如圖:
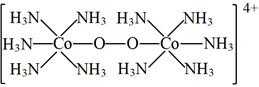
Ⅰ.活化氧氣:[Co(NH3)6]2+在氨水中與氧氣作用生成具有強氧化性的微粒X(其中Co的化合價為+3),X的結構如圖所示。
(1)用“□”標識出X中體現強氧化性的基團:。
Ⅱ.配位[Co(NH3)6]2+較鈷的其它配位離子易吸收NO生成[Co(NH3)5NO]2+,將NO由氣相轉入液相。溶液的pH對NO的配位脫除率的影響如圖所示。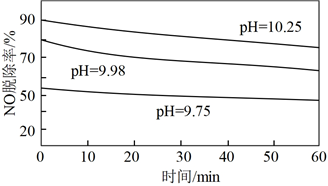
(2)圖中pH=9.75時,NO脫除率較低,其原因可能是。
Ⅲ.氧化吸收:[Co(NH3)5NO]2+被X氧化為[Co(NH3)5NO2]2+,[Co(NH3)5NO2]2+在氨水中生成硝酸銨和亞硝酸銨,達到脫除NO的效果。
(3)用活性炭作催化劑、水作還原劑可實現[Co(NH3)6]2+的再生,維持溶液脫除NO的能力,可能機理如圖所示。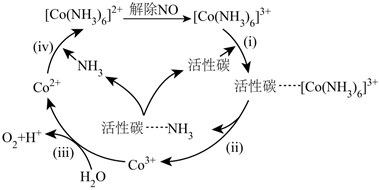
已知:活性炭表面既有大量的酸性基團,又有大量的堿性基團。溶液的pH對活性炭表面所帶電荷有影響。pH>6.5時帶負電荷,pH越高,表面所帶負電荷越多;pH<3.5時帶正電荷,pH越低,表面所帶正電荷越多。
①由步驟(ii)可知活性炭表面有大量的(填“酸性”或“堿性”)基團。
②寫出步驟(iii)的離子反應方程式:。
(4)一定溫度下,pH對再生反應的影響如圖所示。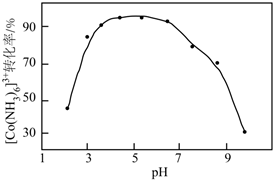
①當pH<3.5時,[Co(NH3)6]3+的轉化率隨pH的減小而降低的原因是。當pH>6.5時,[Co(NH3)6]3+的轉化率隨pH的增大而降低的原因是。
(5)一定pH下,反應相同時間,[Co(NH3)6]3+的轉化率隨溫度的升高而增大,可能的原因是。(至少答出2點)組卷:26引用:2難度:0.6


