2021-2022學年山東省泰安二中高二(上)期中化學試卷
發布:2025/1/2 16:0:3
一、單選題(每小題2分,共20分)
-
1.在C(s)+CO2(g)=2CO(g)反應中,可使反應速率增大的措施是( )
①增大壓強 ②增加炭的量 ③通入CO2④恒壓下充入N2 ⑤恒容下充入N2 ⑥升溫。A.①③④ B.①③⑥ C.②④⑥ D.③⑤⑥ 組卷:47引用:4難度:0.9 -
2.原電池的電極名稱不僅與電極材料的性質有關,也與電解質溶液有關.下列說法中正確的是( )
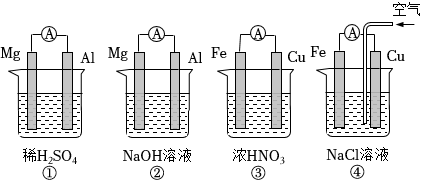
A.①②中Mg作負極,③④中Fe作負極 B.②中Mg作正極,電極反應式為:2H2O+2e-═2OH-+H2↑ C.③中Fe作負極,電極反應式為Fe-2e-═Fe2+ D.④中Cu作正極,電極反應式為2H++2e-═H2↑ 組卷:94引用:7難度:0.7 -
3.對于反應:4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列為四種不同情況下測得的反應速率,其中能表明該反應進行最快的是( )
A.v(NH3)=0.2mol?L-1?s-1 B.v(O2 )=0.24 mol?L-1?s-1 C.v(H2O)=0.25 mol?L-1?s-1 D.v(NO)=0.15 mol?L-1?s-1 組卷:369引用:20難度:0.7 -
4.假設圖中原電池產生的電壓、電流強度均能滿足電解、電鍍要求,即為理想化。①~⑧為各裝置中的電極編號。當K閉合后,下列說法正確的有( )
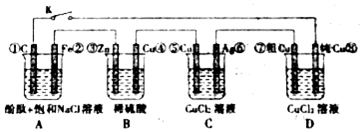
①D 裝置中純Cu 電極反應為:Cu2++2e-=Cu
②整個電路中電子的流動方向為:③→②; ①→⑧; ⑦→⑥;⑤→④;
③C 裝置原理上是一個電鍍池(Ag表面鍍Cu),期中Cu作陰極,Ag作陽極
④A裝置中C電極反應為:O2+4e-+2H2O=4OH-。A.③④ B.①② C.②③④ D.①②④ 組卷:72引用:6難度:0.5 -
5.堿性電池具有容量大、放電電流大的特點而得到廣泛應用。鋅錳堿性電池以氫氧化鉀溶液為電解液,電池總反應式為:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s),下列說法錯誤的是( )
A.電池工作時,鋅失去電子 B.電池正極電極反應式 2MnO2(s)+2H2O(l)+2e-═2MnOOH(s)+2OH-(aq) C.用該電池電解水時,電子通過外電路流向電解池陽極 D.外電路中每通過0.2mol電子,鋅的質量理論上減小6.5g 組卷:29引用:1難度:0.7 -
6.常溫下,下列有關電解質溶液的敘述正確的是( )
A.等濃度等體積的強酸與強堿溶液混合后,溶液的pH=7 B.pH=5的硫酸溶液加水稀釋500倍,則稀釋后c( )與c(H+)的比值為1:2SO2-4C.pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等體積混合后溶液的pH=10.7(已知lg2=0.3) D.將10 mL pH=a的鹽酸與100 mL pH=b的Ba(OH)2溶液混合后恰好中和,則a+b=13 組卷:23引用:3難度:0.7
三、第II卷(非選擇題)
-
19.某實驗小組通過鐵與鹽酸反應的實驗,研究影響反應速率的因素(鐵的質量相等,鐵塊的形狀一樣,鹽酸均過量),設計實驗如表:
(1)若四組實驗均反應進行1分鐘(鐵有剩余),則以上實驗需要測出的數據是實驗編號 鹽酸濃度/(mol L/1) 鐵的形態 溫度/K 1 4.00 塊狀 293 2 4.00 粉末 293 3 2.00 塊狀 293 4 2.00 粉末 313 。
(2)實驗和(填實驗編號)是研究鹽酸的濃度對該反應速率的影響;實驗1和2是研究對該反應速率的影響。
(3)測定在不同時間產生氫氣體積V的數據,繪制出圖甲,則曲線c、d分別對應的實驗組別可能是、。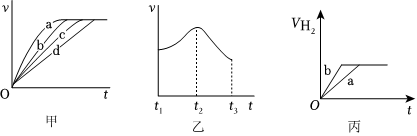
(4)分析其中一組實驗,發現產生氫氣的速率隨時間變化情況如圖乙所示。
①其中t1~t2速率變化的主要原因是。
②t2~t3速率變化的主要原因是。
(5)實驗1產生氫氣的體積如丙中的曲線a,添加某試劑能使曲線a變為曲線b的是。
A.CuO粉末 B.NaNO3固體 C.NaCl溶液 D.濃H2SO4組卷:21引用:3難度:0.7 -
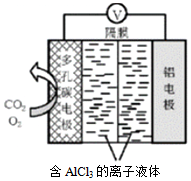 20.對溫室氣體CO2進行減排和綜合治理具有重要意義。回答下列問題:
20.對溫室氣體CO2進行減排和綜合治理具有重要意義。回答下列問題:
Ⅰ.(1)O2輔助的Al~CO2電池工作原理如圖所示。該電池電容量大,能有效利用CO2,電池反應產物Al2(C2O4)3是重要的化工原料。電池的負極反應式:。電池的正極反應式:6O2+6e?═6O2?;6CO2+6O2?=3C2O42?+6O2
(2)反應過程中O2的作用是。
(3)該電池的總反應式:。
Ⅱ.CH4-CO2催化重整不僅對溫室氣體的減排具有重要意義,還可以得到合成氣(CO和H2)。
已知:
①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ/mol K1
②CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH2=+165.0kJ/mol K2
(4)寫出該催化重整反應的熱化學方程式。K=(用 K1、K2表示)
(5)恒溫恒壓下,向容器中加入2mol CH4、1mol CO2以及催化劑進行重整反應,此時體積為2L,一段時間后達到平衡時,CO2的轉化率是50%,其平衡常數為。
(6)分別在VL恒溫密閉容器A(恒容)、B(恒壓,容積可變)中,加入CH4和CO2各1mol的混合氣體讓其發生催化重整反應。兩容器中反應達平衡后放出或吸收的熱量較多的是(填“A”或“B”)。組卷:9引用:1難度:0.4


