2020-2021學年天津市和平區高三(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共12小題,每小題3分,滿分36分)
-
1.下列有關化學及人類社會發展歷程的說法中,不正確的是( )
A.道爾頓的“原子論”對化學的發展起到了極大的推動作用 B.門捷列夫將元素按原子序數由小到大的順序排列,制出了首張元素周期表 C.古劍“沈盧以劑鋼為刃,柔鐵為莖干,不爾則多斷折”,劑鋼是鐵的合金 D.古書中“冬月灶中所燒薪柴之灰,令人以灰淋汁,取堿浣衣”中的堿是K2CO3 組卷:35引用:1難度:0.7 -
2.下列有關化學反應的敘述正確的是( )
A.Fe在稀硝酸中發生鈍化 B.MnO2和稀鹽酸反應制取Cl2 C.SO2與過量氨水反應生成(NH4)2SO3 D.室溫下Na與空氣中O2反應制取Na2O2 組卷:842引用:8難度:0.8 -
3.下列的說法正確的是( )
A.CaCl2的電子式: 
B.電負性大小:H<C<O<N C.乙烯中碳原子間存在σ鍵和π鍵 D.純堿溶液呈堿性的原因:CO32-+2H2O?H2CO3+2OH- 組卷:26引用:1難度:0.6 -
4.下列有關實驗操作的敘述不正確的是( )
A.可用氨水除去試管內壁上的銀鏡 B.用容量瓶配制溶液,定容時俯視刻度線,所配溶液濃度偏大 C.蒸餾完畢后,應先停止加熱,待裝置冷卻后,停止通水,再拆卸蒸餾裝置 D.用標準鹽酸溶液滴定氨水來測定其濃度,選擇甲基橙為指示劑 組卷:14引用:1難度:0.5 -
 5.1mol白磷(P4,s)和4mol紅磷(P,s)與氧氣反應過程中的能量變化如圖(E表示能量)。下列說法正確的是( )
5.1mol白磷(P4,s)和4mol紅磷(P,s)與氧氣反應過程中的能量變化如圖(E表示能量)。下列說法正確的是( )A.P4(s,白磷)=4P(s,紅磷)△H>0 B.以上變化中,白磷和紅磷所需活化能相等 C.白磷比紅磷穩定 D.紅磷燃燒的熱化學方程式是4P(s,紅磷)+5O2(g)=P4O10(s)△H=-(E2-E3)kJ/mol 組卷:136引用:9難度:0.6
二、解答題(共4小題,滿分64分)
-
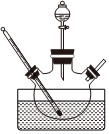 15.實驗室通常是在NH3和NH4Cl存在條件下,以活性炭為催化劑,用H2O2氧化CoCl2溶液來制備三氯化六氨合鈷[Co(NH3)6]Cl3,該反應屬于大量放熱的反應。某小組用如圖所示裝置制備[Co(NH3)6]Cl3,實驗步驟如下:
15.實驗室通常是在NH3和NH4Cl存在條件下,以活性炭為催化劑,用H2O2氧化CoCl2溶液來制備三氯化六氨合鈷[Co(NH3)6]Cl3,該反應屬于大量放熱的反應。某小組用如圖所示裝置制備[Co(NH3)6]Cl3,實驗步驟如下:
Ⅰ.稱取研細的CoCl2?6H2O10.0g和NH4Cl5.0g于燒杯中溶解,將溶液轉入三頸燒瓶,加入25mL濃氨水和適量活性炭粉末,逐滴加入5mL 30%的H2O2溶液。
Ⅱ.用水浴將混合物加熱至60℃,恒溫20分鐘,然后用冰水浴冷卻,充分結晶后過濾。
Ⅲ.將沉淀溶于熱的鹽酸中,趁熱過濾,濾液中加適量濃鹽酸并冷卻結晶。
Ⅳ.過濾、用乙醇洗滌晶體并在105℃條件下烘干。
試回答下列問題:
(1)制備[Co(NH3)6]Cl3的化學方程式是。
(2)請指出裝置中存在的一處缺陷。
(3)若將5mL 30%的H2O2溶液一次性加入三頸燒瓶,會出現的問題是。
(4)與[Co(NH3)6]Cl3類似的產品還有[Co(NH3)5Cl]Cl2,請簡述驗證某晶體是[Co(NH3)6]Cl3還是[Co(NH3)5?Cl]Cl2的實驗方案。
(5)步驟Ⅲ中趁熱過濾的主要目的是,濾液中加適量濃鹽酸的主要目的是。
(6)乙醇洗滌與蒸餾水洗滌相比優點是。組卷:43引用:4難度:0.5 -
16.CO是合成尿素、甲酸的原料。

(1)合成尿素的反應:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H=-81.0kJ?mol-1;T℃時,在體積為2L的恒容密閉容器中,將2mol的NH3和1mol CO混合反應,5min時,NH3的轉化率為80%。則0~5min平均反應速率為v(CO)=。
已知:398K時,K=126.5,則:498時,K1126.5(填“>”或“<”);其判斷理由是。
若保持恒溫恒容條件,將物質的量之和為3mol的NH3和CO以不同的氨碳比進行反應,結果如圖1所示:
①若圖1中c表示平衡體系中尿素的體積分數,則a表示的轉化率。
②當=n(NH3)n(CO)時,尿素含量最大;此時,對于該反應既能增大正反應速率又能使平衡正向移動的措施是。(寫一種)
(2)通過人工光合作用可將CO轉化成HCOOH。常溫下,濃度均為0.1mol?L-1的HCOOH和HCOONa混合溶液pH=3.7,則HCOOH的電離常數Ka=(已知lg2=0.3)。用電化學可消除HCOOH對水質造成的污染,其原理是電解CoSO4、稀硫酸和HCOOH混合溶液,用電解產生的Co3+將HCOOH氧化成CO2。
①Co3+氧化HCOOH的離子方程式為。
②忽略體積變化,電解前后Co2+的濃度將。(填“增大”、“不變”或“減小”)
(3)用甲酸鈉燃料電池【以Na+交換膜(CEM)為隔膜】制備燒堿,如圖2所示:
①正極區,O2發生還原反應生成。
②電池工作時鈉離子通過CEM膜由極區向極區移動。組卷:27引用:1難度:0.4


