2016-2017學年山東省棗莊市滕州二中新校高三(上)第四周周清檢測化學試卷
發布:2024/4/20 14:35:0
一、選擇題
-
1.化學與能源開發、環境保護、資源利用等密切相關.下列說法正確的是( )
A.“無磷洗滌劑”的推廣使用,不能有效減少水體富營養化的發生 B.無論是風力發電還是火力發電,都是將化學能轉化為電能 C.PM2.5含有的鉛、鎘、鉻、釩、砷等對人體有害的元素均是金屬元素 D.硫的氧化物和氮的氧化物是形成酸雨的主要物質 組卷:10引用:4難度:0.9 -
2.據最新報道,科學家發現了如下反應:O2+PtF6=O2(PtF6),已知O2(PtF6)為離子化合物,其中Pt為+5價,對于此反應,下列敘述正確的是( )
A.在此反應中,每生成1molO2(PtF6),則轉移1mol電子 B.在此反應中,O2是氧化劑,PtF6是還原劑 C.O2(PtF6)中氧元素的化合價是+1價 D.O2(PtF6)中僅存在離子鍵不存在共價鍵 組卷:18引用:7難度:0.9 -
3.NA為阿伏加德羅常數的值.下列敘述正確的是( )
A.常溫下將28 g Fe投入到足量的濃硝酸中,可得到標準狀況下33.6 L NO2 B.任何條件下,64 gSO2中含有的原子數目一定為3 NA C.25℃時pH=13的NaOH溶液中含有OH一的數目為0.1 NA D.1 mol Na2O2反應生成O2時,必失去2 NA個電子 組卷:4引用:3難度:0.9 -
4.能正確表示下列反應的離子方程式為( )
A.向明礬(KAl(SO4)2?12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ B.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O C.玻璃試劑瓶被燒堿溶液腐蝕:SiO2+2Na++2OH-=Na2SiO3↓+H2O D.VO2+與酸性高錳酸鉀溶液反應:5VO2++MnO4-+H2O═5VO2++Mn2++2H+ 組卷:7引用:4難度:0.7 -
5.常溫下,下列各組離子一定能在指定溶液中大量共存的是( )
A.c(I-)=0.1mol?L-1的溶液中:Na+、Mg2+、ClO-、 SO2-4B.使甲基橙變紅色的溶液中:K+、 、NH+4、Cl-HCO-3C.與Al反應能放出大量H2的溶液中:Fe2+、Na+、 、Cl-NO-3D.由水電離產生的c(OH-)=1×10-10 mol?L-1的溶液中:Ba2+、K+、 、Br-NO-3組卷:29引用:4難度:0.7 -
6.等質量的下列物質與足量濃鹽酸反應(必要時可加熱),放出Cl2物質的量最多的是( )
A.KMnO4 B.MnO2 C.NaClO3 D.NaClO 組卷:38引用:9難度:0.9 -
7.氮氧化鋁(AlON)是一種透明高硬度防彈材料,可以由反應Al2O3+C+N2
2AlON+CO合成,下列有關說法正確的是( )高溫A.氮氧化鋁中氮的化合價是-3 B.反應中氧化產物和還原產物的物質的量之比是2:1 C.反應中每生成5.7g AlON 同時生成1.12 L CO D.反應中氮氣被還原 組卷:69引用:8難度:0.9 -
8.在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol鐵粉,充分攪拌后鐵完全反應,同時析出0.1mol Ag.則下列結論中不正確的是( )
A.向反應后的溶液中繼續加入少量鐵粉,鐵粉可以繼續溶解 B.氧化性:Ag+>Fe3+>Cu2+>Zn2+ C.反應后溶液的質量減輕 D.反應后溶液中Cu2+與Fe2+的物質的量之比為1:1 組卷:59引用:12難度:0.7 -
9.我國科學家研發成功了甲烷和二氧化碳的共轉化技術,利用分子篩催化劑高效制得乙酸.下列有關說法正確的是( )
A.所有反應物和產物中都既含極性鍵又含非極性鍵 B.消耗22.4L CO2可制得乙酸60g C.該反應不是氧化還原反應 D.該反應過程符合“綠色化學”原理,原子利用率達100% 組卷:87引用:6難度:0.9 -
10.合成二甲醚的三步反應如下:
2H2(g)+CO(g)?CH3OH(g)△H1
2CH3OH (g)?CH3OCH3 (g)+H2O(g)△H2
CO(g)+H2O(g)?CO2(g)+H2(g)△H3
則 3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g) 的△H是( )A.△H=2△H1+△H2+△H3 B.△H=△H1+△H2+△H3 C.△H=△H1+2△H2+2△H3 D.△H=2△H1+△H2-△H3 組卷:79引用:12難度:0.9
三、實驗題
-
29.銨明礬是一種廣泛應用于醫藥、食品、污水處理等多個行業的重要化工產品.以高嶺土(含SiO2、Al2O3、少量Fe2O3等)為原料制備硫酸鋁晶體[Al2(SO4)3?18H2O]和銨明礬[NH4Al(SO4)2?12H2O]的實驗方案如圖所示.
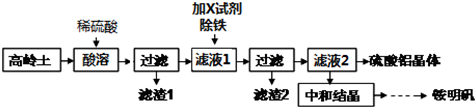
請回答下列問題:
(1)高嶺土首先需要灼燒,實驗室灼燒高嶺土所需的實驗儀器有(填字母).
a.蒸發皿 b.泥三角 c.漏斗 d.酒精燈 e.三腳架 f.坩堝 g.燒杯 h.試管
(2)寫出酸溶過程中發生反應的離子方程式:.
(3)檢驗濾液2中是否含有Fe3+的實驗方法為:;濾渣2的主要成分為:(填化學式).
(4)濾液2→硫酸鋁晶體的操作包含的實驗步驟有:、、、洗滌、干燥.
(5)中和結晶操作是將過濾出硫酸鋁晶體后的濾液,先用硫酸調節酸鋁比(溶液中游離硫酸和硫酸鋁的物質的量之比),再用氨水中和至一定的pH值即可析出銨明礬晶體,寫出該過程中的總反應方程式:.組卷:7引用:4難度:0.5 -
30.金屬鈦及鈦的合金被認為是21世紀重要的金屬材料.常溫下鈦不和非金屬酸反應.以鈦鐵礦【主要成分為FeTiO3(鈦酸亞鐵,不溶于水)、Fe2O3及少量SiO2雜質】為主要原料冶煉金屬鈦的主要工藝過程如下:
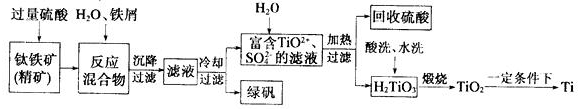
回答下列問題:
(1)綠礬的化學式是.
(2)FeTiO3與過量硫酸反應的離子方程式為.
(3)取少量酸洗后的H2TiO3,加入鹽酸并振蕩,滴加KSCN溶液后無明顯現象,再加H2O2后出現微紅色,說明H2TiO3中存在的雜質離子是.這種H2TiO3即使用水充分洗滌,煅燒后獲得的TiO2也會發黃,發黃的雜質是(填化學式).
(4)以TiO2為原料制取金屬鈦的其中一步反應為TiO2、氯氣和焦炭反應生成TiCl4,已知該反應中氧化劑與還原劑的物質的量之比為1:1,則另一生成物為.
(5)用Mg還原TiCl4制金屬鈦取過程中必須在1070K的溫度下進行,你認為還應該控制的反應條件是;所得到的金屬鈦中混有少量雜質,可加入溶解后除去.組卷:3引用:2難度:0.3


