2020-2021學年河北省石家莊二中高二(上)開學化學試卷
發布:2024/12/11 23:0:1
一、選擇題
-
1.反應8NH3+3Cl2═6NH4Cl+N2可用于氯氣管道的檢漏。下列表示相關微粒的化學用語正確的是( )
A.中子數為9的氮原子: N97B.N2分子的電子式: 
C.Cl2分子的結構式:Cl-Cl D.Cl-的結構示意圖:  組卷:568引用:22難度:0.8
組卷:568引用:22難度:0.8 -
2.短周期主族元素X、Y、Z、W的原子序數依次增大,Z可與X形成淡黃色化合物Z2X2,Y、W最外層電子數相同。下列說法正確的是( )
A.氫化物的沸點:Y>X B.簡單離子的還原性:Y>X>W C.簡單離子的半徑:W>X>Y>Z D.氫化物水溶液的酸性:Y>W 組卷:5引用:1難度:0.5 -
3.X、Y、Z、M、Q五種短周期元素,原子序數依次增大。Y元素的最高正價為+4價,Y元素與Z、M元素相鄰,且與M元素同主族;化合物Z2X4的電子總數為18個;Q元素的原子最外層電子數比次外層少一個電子。下列說法不正確的是( )
A.原子半徑:Z<Y<M B.最高價氧化物對應水化物的酸性:Z>Y>M C.X、Y和氧三種元素形成的陰離子有2種以上 D.X、Z和Q三種元素形成的化合物一定是共價化合物 組卷:11引用:1難度:0.5 -
 4.短周期元素W、X、Y、Z的原子序數依次增大,其中Z為金屬且Z的原子序數為W的2倍。n、p、q是由這些元素組成的二元化合物,常溫下n為氣體。m、r、s分別是Z、W、X的單質,t的水溶液顯堿性且焰色反應呈黃色,上述物質間的轉化關系如圖所示。下列說法正確的是( )
4.短周期元素W、X、Y、Z的原子序數依次增大,其中Z為金屬且Z的原子序數為W的2倍。n、p、q是由這些元素組成的二元化合物,常溫下n為氣體。m、r、s分別是Z、W、X的單質,t的水溶液顯堿性且焰色反應呈黃色,上述物質間的轉化關系如圖所示。下列說法正確的是( )A.X元素的一種核素可用于測定文物的年代 B.2.4gm在足量的n中充分燃燒,固體質量增加1.6g C.最簡單氣態氫化物的穩定性:W>X D.n+p→s+t的過程中,有離子鍵、共價鍵的斷裂,也有離子鍵、共價鍵的形成 組卷:9引用:1難度:0.6 -
5.a、b、c、d 為短周期元素,原子序數依次增大。a 原子最外層電子數等于電子層數的 3 倍,a 和b能組成兩種常見的離子化合物,其中一種含兩種化學鍵,d 的最高價氧化物對應的水化物和氣態氫化物都是強酸。向 d 的氫化物的水溶液中逐滴加入 bca2溶液,開始沒有沉淀;隨著 bca2 溶液的不斷滴加,逐漸產生白色沉淀。下列推斷正確的是( )
A.最高價氧化物對應水化物的堿性:b<c B.簡單離子半徑:b>c>a C.工業上電解熔融 cd3 可得到c的單質 D.b、c、d 最高價氧化物對應水化物之間可兩兩反應 組卷:16引用:2難度:0.7 -
6.下列實驗能達到預期目的是( )
實驗內容 實驗目的 A 將0.2mol?L-1的KI溶液和0.05mol?L-1的FeCl3溶液等
體積混合,充分反應后,取少許混合液滴加AgNO3溶液驗證Fe3+與I-的反應有
一定限度B 白鐵皮(鍍鋅鐵)出現刮痕后浸泡在飽和食鹽水中,一段
時間后滴入幾滴K3[Fe(CN)6]溶液驗證該過程是否發生
原電池反應C 相同條件下,向一支試管中加入2mL5%H2O2和1mLH2O,
向另一支試管中加入2mL5%H2O2和1mLFeCl3溶液,
觀察并比較實驗現象探究FeCl3對H2O2分
解速率的影響D 向2支盛有5mL不同濃度NaHSO3溶液的試管中,同時
加入2mL5%H2O2溶液,觀察并比較實驗現象探究濃度對反應速率
的影響A.A B.B C.C D.D 組卷:46引用:8難度:0.5 -
7.氫氣與氧氣生成水的反應是氫能源應用的重要途徑。下列有關說法正確的是( )
A.一定溫度下,反應2H2(g)+O2(g)═2H2O(g)能自發進行,該反應的△H<0 B.氫氧燃料電池的負極反應為O2+2H2O+4e-═4OH- C.常溫常壓下,氫氧燃料電池放電過程中消耗11.2L H2,轉移電子的數目為6.02×1023 D.同溫同壓下,2H2(g)+O2(g)═2H2O(g),在燃料電池和點燃條件下的△H不同 組卷:11引用:2難度:0.7 -
8.下列示意圖與化學用語表述內容不相符的是(水合離子用相應離子符號表示)( )
A. 
NaCl═Na++Cl-B. 
CuCl2═Cu2++2Cl-C. 
CH3COOH?CH3COO-+H+D. 
H2(g)+Cl2(g)═2HCl(g)△H=-183kJ?mol-1組卷:546引用:3難度:0.7 -
9.理論研究表明,在101kPa和298K下,HCN(g)?HNC(g)異構化反應過程的能量變化如圖所示。下列說法錯誤的是( )
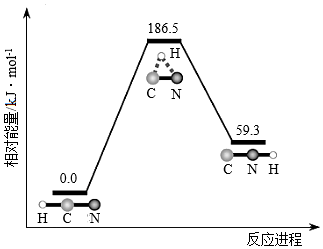
A.HCN比HNC穩定 B.該異構化反應的ΔH=+59.3kJ?mol-1 C.正反應的活化能大于逆反應的活化能 D.使用催化劑,可以改變反應的反應熱 組卷:1060引用:29難度:0.6
二、解答題
-
28.多晶硅是制作光伏電池的關鍵材料。以下是由粗硅制備多晶硅的簡易過程。
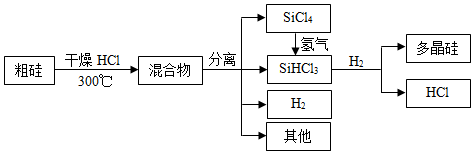
回答下列問題:
Ⅰ.硅粉與HCl在300℃時反應生成1molSiHCl3氣體和H2,放出225kJ熱量,該反應的熱化學方程式為。SiHCl3的電子式為。
Ⅱ.將SiCl4氫化為SiHCl3有三種方法,對應的反應依次為:
①SiCl4(g)+H2(g)?SiHCl3(g)+HCl(g)△H1>0
②3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g)△H2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g)?3SiHCl3(g) △H3
(1)氫化過程中所需的高純度H2可用惰性電極電解KOH溶液制備,寫出產生H2的電極名稱(填“陽極”或“陰極”),該電極反應方程式為。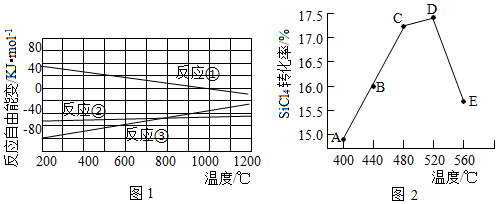
(2)已知體系自由能變△G=△H-T△S,△G<0時反應自發進行。三個氫化反應的△G與溫度的關系如圖1所示,可知:反應①能自發進行的最低溫度是;相同溫度下,反應②比反應①的△G小,主要原因是。
(3)不同溫度下反應②中SiCl4轉化率如圖2所示。下列敘述正確的是(填序號)。
a.B點:v正>v逆
b.v正:A點>E點
c.反應適宜溫度:480~520℃
(4)反應③的△H3=(用△H1,△H2表示)。溫度升高,反應③的平衡常數K(填“增大”、“減小”或“不變”)。
(5)由粗硅制備多晶硅過程中循環使用的物質除SiCl4、SiHCl3和Si外,還有(填分子式)。組卷:785引用:6難度:0.4 -
29.天然氣的主要成分為CH4,一般還含有C2H6(乙烷)等,是重要的燃料和化工原料。
(1)乙烷在一定條件可發生如下反應:C2H6(g)?C2H4(g)+H2(g)ΔH,若容器中通入等物質的量的乙烷和氫氣,在等壓下(p)發生上述反應,乙烷的平衡轉化率為α。反應的平衡常數Kp=(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(2)高溫下,甲烷生成乙烷的反應如下:2CH4C2H6。反應在初期階段的速率方程為:r=k×c(CH4),其中k為反應速率常數。高溫
①設反應開始時的反應速率為r1,甲烷的轉化率為α時的反應速率為r2,則r2=r1。
②對于處于初期階段的該反應,下列說法正確的是。
A.增加甲烷濃度,r增大
B.增加H2濃度,r增大
C.乙烷的生成速率逐漸增大
D.降低反應溫度,k減小
(3)CH4和CO2都是比較穩定的分子,科學家利用電化學裝置實現兩種分子的耦合轉化,其原理如圖所示: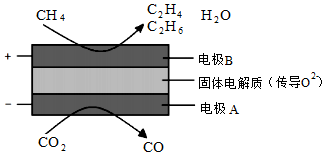
①陰極上的反應式為。
②若生成的乙烯(C2H4)和乙烷(C2H6)的體積比為2:1,則消耗的CH4和CO2體積比為。組卷:35引用:1難度:0.5


