科粵版九年級下冊《6.2 金屬的化學性質》2022年同步練習卷(1)
發布:2024/11/7 18:0:2
一、單選題
-
1.取鎂、鋁兩種金屬的混合物12.6g,加入到一定量的稀硫酸中恰好完全反應,反應后溶液質量增加了11.4g。將反應后的溶液蒸發結晶、干燥,所得固體質量為( )
A.24.0g B.36.6g C.70.2g D.82.4g 組卷:118引用:4難度:0.5 -
2.現有甲、乙、丙三種金屬,先將三者分別加入到硫酸亞鐵溶液中,只有甲可使溶液中析出鐵單質。再將三者加入到硝酸銀溶液中,只有乙不能使溶液中析出銀單質,則三者的金屬活動性從大到小的順序是( )
A.甲>乙>丙 B.乙>甲>丙 C.甲>丙>乙 D.無法判斷 組卷:518引用:24難度:0.7 -
 3.在一個密閉容器中,有甲、乙、丙、丁、戊五種物質,在一定條件下發生反應,測得反應前后各物質的質量變化量如圖所示,下列說法正確的是( )
3.在一個密閉容器中,有甲、乙、丙、丁、戊五種物質,在一定條件下發生反應,測得反應前后各物質的質量變化量如圖所示,下列說法正確的是( )A.該反應一定屬于置換反應 B.戊一定是該反應的催化劑 C.參加反應的乙、丙的質量比一定為48:23 D.該反應中甲、丁的相對分子質量之比一定為44:27 組卷:666引用:34難度:0.5 -
4.下列化學反應屬于置換反應的是( )
A.H2O+CaO═Ca(OH)2 B.Na2SO4+BaCl2═2NaCl+BaSO4↓ C.H2+CuO Cu+H2O△D.3CO+Fe2O3 2Fe+3CO2高溫組卷:524引用:10難度:0.5 -
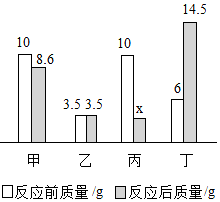 5.在密閉容器中放入甲、乙、丙、丁四種物質,一定條件下發生化學反應,一段時間后,測得相關數據如圖所示,下列說法正確的是( )
5.在密閉容器中放入甲、乙、丙、丁四種物質,一定條件下發生化學反應,一段時間后,測得相關數據如圖所示,下列說法正確的是( )A.x=3.1 B.該反應中甲、丁的質量變化比為14:85 C.該反應屬于置換反應 D.乙一定是該反應的催化劑 組卷:391引用:25難度:0.7 -
6.某興趣小組的同學將一塊不純的鐵片5.6g投入到足量的稀鹽酸中,充分反應后生成了0.2g氣體,則該鐵片中混有的雜質一定不可能是( )
A.鋁和鋅 B.鎂和鋅 C.鎂和銅 D.鋅和銅 組卷:184引用:49難度:0.7 -
7.將甲、乙兩種金屬片分別放入硫酸銅溶液中,甲表面析出金屬銅,乙沒有明顯現象.據此判斷三種金屬的金屬活動性順序是( )
A.甲>銅>乙 B.乙>銅>甲 C.銅>甲>乙 D.甲>乙>銅 組卷:157引用:81難度:0.7
二、綜合應用題
-
21.日常使用的干電池是一種鋅錳電池,它的構造是:負極為鋅做的圓筒,正極是一根碳棒,它的周圍被二氧化錳,碳粉和氯化銨的混合劑所包圍,總稱為“碳包“.碳包和鋅筒之間填充著氯化銨、氯化鋅的水溶液和淀粉等組成的糊狀物.廢舊干電池隨意丟棄會造成環境污染.學校興趣小組同學準備對廢舊的干電池進行探究.
(一)拆解干電池,得到銅帽、鋅皮、碳棒、黑色粉末等物質.
(二)回收二氧化錳并測定碳粉與二氧化錳的質量比:(如圖1)
(1)干電池使用時將化學能轉化成能.
(2)上述操作中灼燒的目的是;
(3)同學們將過濾后得到的濾渣干燥后稱得質量為25克,充分灼燒后冷卻稱得剩余固體質量為20克,則濾渣中二氧化錳與碳粉的質量比為.經分析,此結果偏大,老師指出同學們在實驗中缺少一步操作,該操作是.
(4)為驗證二氧化錳,同學們用A、B兩支潔凈試管,分別取5毫升3%的過氧化氫溶液,往A試管中加入少量上述實驗灼燒后得到的固體,如果出現的現象,說明為二氧化錳.反應的化學方程式為.
(三)用拆解得到的鋅皮(含雜質)制取硫酸鋅晶體.
實驗步驟:①將剪碎后的鋅皮放入燒杯中,加入足量的稀硫酸,充分反應;②將上述反應后的混合物過濾.③將濾液加熱濃縮、、過濾,得到ZnSO4?7H2O晶體.
(5)步驟①中反應方程式為,將鋅皮剪碎的目的是.
(6)步驟②需要的儀器有鐵架臺、燒杯、和玻璃棒,玻璃棒的作用是.
(7)步驟③缺少的操作是.
(四)測定鋅皮中鋅的質量分數.同學們設計了如圖2實驗裝置,取1克鋅皮放于試管中,實驗中將注射器內50毫升稀硫酸(足量)完全注入試管中.當試管中不再產生氣泡時立刻讀數得到量筒中水的體積為350毫升.已知實驗條件下氫氣的密度為0.09g/L.
(8)計算該鋅皮中鋅的質量分數.
(9)上述方法測得的鋅的質量分數偏大,不可能的原因是
A.沒等裝置冷卻就讀數
B.鋅皮中含有少量鐵
C.試管中有氣體沒有排出
D.將注射器中稀硫酸全部注入試管中后忘掉夾緊彈簧夾.組卷:34引用:2難度:0.3 -
22.比較與歸納是學習化學的重要方法.請你分析下列兩表中的數據,找出對應規律.
(1)
(2)1g金屬與足量稀鹽酸反應
(均生成+2價金屬的鹽溶液)Mg Fe Zn 金屬的相對原子質量 24 56 65 產生氧氣的質量(g) 224256265你發現的規律是
氣體 H2 N2 O2 Cl2 氣體的相對分子質量 2 28 32 71 標準狀況下的氣體密度(g/L) 0.0899 1.251 1.429 3.214 你發現的規律是 組卷:31引用:3難度:0.3


