2017-2018學年福建省龍巖一中高二(下)第三次模塊化學試卷
發布:2024/4/20 14:35:0
一.單項選擇題(本題包括15小題,每小題2分,共30分.下列每小題所給選項只有一項符合題意,請將正確答案的序號填涂在答題卡上)
-
1.下列化學用語表示正確的是( )
A.甲基的電子式 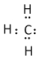
B.氯離子的最外層電子排布式3S23P6 C.氮原子的軌道表示式 
D.銅原子的結構示意圖 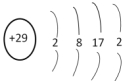 組卷:7引用:1難度:0.9
組卷:7引用:1難度:0.9 -
2.最近發現一種由鈦原子和碳原子構成的氣態團簇分子如圖所示,它的化學式是( )

A.Ti14C13 B.Ti4C4 C.TiC D.Ti14C12 組卷:76引用:4難度:0.9 -
3.有四種不同堆積方式的金屬晶體的晶胞如圖所示,有關說法正確的是( )
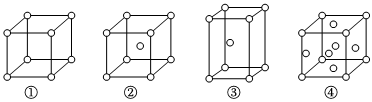
A.①為簡單立方堆積②為六方最密堆積③為體心立方堆積④為面心立方最密堆積 B.每個晶胞含有的原子數分別為:①1個,②2個,③2個,④4個 C.晶胞中原子的配位數分別為:①6,②8,③8,④12 D.空間利用率的大小關系為:①<②<③<④ 組卷:673引用:21難度:0.7 -
4.下列說法中,正確的是( )
A.s區和p區都是主族元素,d區都是副族元素 B.同一主族元素,從上到下,元素的第一電離能依次增大 C.同電負性變化規律一樣,從左到右,同周期元素的第一電離能依次增大 D.原子軌道能量比較:E(3d)>E(4s)>E(3s) 組卷:37引用:1難度:0.9 -
5.用VSEPR模型預測下列分子或離子的立體結構,其中不正確的是( )
A. 為正四面體形NH+4B.CS2為直線形 C.HCN為折線形(V形) D.PCl3為三角錐形 組卷:130引用:6難度:0.9 -
6.氯化亞砜(SOCl2)是一種很重要的化學試劑,可以作為氯化劑和脫水劑。下列關于氯化亞砜分子的幾何構型和中心原子(S)采取雜化方式的說法正確的是( )
A.三角錐形、sp3 B.V形、sp2 C.平面三角形、sp2 D.三角錐形、sp2 組卷:412引用:23難度:0.9 -
7.根據等電子原理判斷,下列說法中錯誤的是( )
A.B3N3H6分子中所有原子均在同一平面上 B.B3N3H6分子中存在雙鍵,可發生加成反應 C.H3O+和NH3是等電子體,均為三角錐形 D.CH4和 是等電子體,均為正四面體NH+4組卷:330引用:15難度:0.7 -
8.中心離子的電荷數為3,配位數為3的配合物是( )
A.Fe(SCN)3 B.[Fe(SCN)6]3- C.[Co(NH3)3Cl3] D.[AlF6]3- 組卷:34引用:1難度:0.7 -
9.下列含有極性鍵的非極性分子是( )
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2S ⑦SO2 ⑧CS2 ⑨H2O ⑩HF.A.②③④⑤⑧ B.①③④⑤⑧ C.①③④⑧ D.以上均不對 組卷:32引用:2難度:0.7
三、非選擇題共46分)
-
27.用釩鈦磁鐵礦為原料冶煉鐵,產生一種固體廢料,主要成分如表。
通過圖1所示工藝流程可以實現元素Ti、Al、Si的回收利用,并得到納米二氧化鈦和分子篩。物質 TiO2 MgO SiO2 CaO Al2O3 質量百分含量/% 51.00 12.52 5.39 4.00 19.34 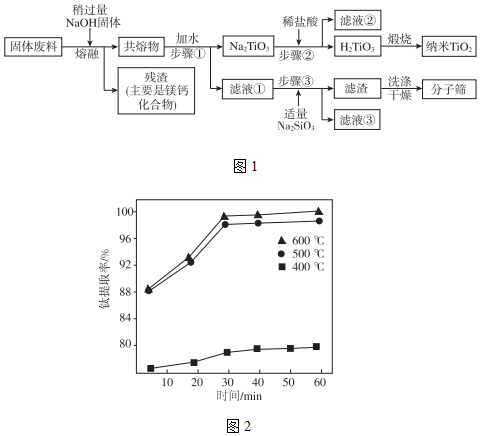
請回答下列問題:
(1)步驟①②③中進行分離操作的名稱是,
(2)下列固體廢料的成分中,不屬于堿性氧化物的是(填字母序號)。
a.TiO2 b.MgO c.SiO2 d.CaO
(3)熔融溫度和鈦的提取率關系如圖2,適宜溫度為500℃,理由是。
(4)濾液①中溶質的成分是。
(5)步驟②中發生反應的離子方程式是。
(6)將步驟③中制取分子篩的化學方程式補充完整:
□+6Na2SiO3+8H2O=Na8Al6O24(OH)2?2H2O+□
根據成分表中數據,計算10kg固體廢料,理論上應再加入Na2Si03物質的量的計算式是n( Na2SiO3)=mol(摩爾質量/g/mol:SiO2 60 Al2O3102)。組卷:113引用:4難度:0.3 -
28.氫氣作為清潔能源有著廣泛的應用前景,含硫天然氣制備氫氣的流程如圖1。
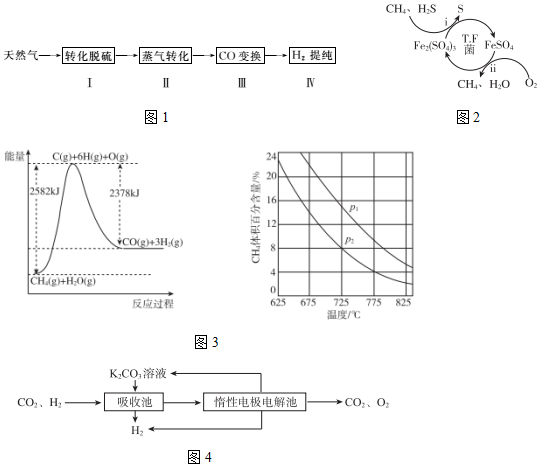
請回答下列問題:
I.轉化脫硫:將天然氣壓入吸收塔,30℃時,在T.F菌作用下,酸性環境中脫硫過程示意圖如圖2。
(1)過程i中H2S發生了(選填“氧化”或“還原”)反應。
(2)過程11的離子方程式是。
(3)已知:①Fe3+在pH=1.9時開始沉淀,pH=3.2時沉淀完全。
②30℃時,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
請結合以上信息,判斷工業脫硫應選擇的最佳pH范圍,并說明原因:pH 0.9 1.2 1.5 1.8 2.1 2.4 2.7 3.0 Fe2+氧化速率/(g?L-1?h-1) 4.5 5.3 6.2 6.8 7.0 6.6 6.2 5.6 。
Ⅱ.蒸氣轉化:在催化劑的作用下,水蒸氣將CH4氧化。結合圖3回答問題。
(4)①該過程的熱化學方程式是。
②比較壓強P1和P2的大小關系:P1P2(選填“>”“<”或“=”)。
Ⅲ.CO變換:500℃時,CO進一步與水反應生成CO2和H2。
Ⅳ.H2提純:將CO2和H2分離得到H2的過程示意圖如圖4。
(5)①吸收池中發生反應的離子方程式是。
②結合電極反應式,簡述K2CO3溶液的再生原理:。組卷:91引用:5難度:0.3


