2019-2020學年吉林省遼源五中高一(下)期中化學試卷
發布:2024/4/20 14:35:0
一.單選(每題2分,共50分)
-
1.化學與生活密切相關,下列有關說法正確的是( )
A.氫氧化鐵膠體具有很強的吸附性,可用于自來水的殺菌消毒 B.燃煤中加入CaO可以減少酸雨的形成及溫室氣體的排放 C.NaClO具有強氧化性,可作織物漂白劑 D.PM2.5指直徑小于或接近2.5微米的顆粒物,在空氣中能產生丁達爾現象 組卷:5引用:1難度:0.7 -
2.下列有關物質用途的敘述中,不正確的是( )
A.Cl2常用于自來水消毒 B.SO2常用于漂白食品 C.SiO2常用于制造光導纖維 D.含碘食鹽可預防甲狀腺腫大 組卷:35引用:2難度:0.8 -
3.關于非金屬元素Si、N、S、Cl的敘述,正確的是( )
A.通常情況下,它們的單質均為氣體 B.它們在自然界這都存在游離態形式 C.每種元素都只有一種氧化物 D.它們都存在對應的含氧酸 組卷:26引用:3難度:0.7 -
4.下表所列各組物質中,物質之間通過一步反應能實現如圖所示轉化的是( )
X Y Z 物質轉化關系 A Cu CuO Cu(OH)2 
B Si SiO2 H2SiO3 C NaHCO3 Na2CO3 NaOH D FeCl2 FeO FeCl3 A.A B.B C.C D.D 組卷:114引用:16難度:0.7 -
5.下列離子方程式正確的是( )
A.向硫酸鋁溶液中加入過量氨水:Al3++3OH-═Al(OH)3↓ B.氯氣溶于水:Cl2+H2O═2H++Cl-+ClO- C.將濃硫酸滴在銅片上:Cu+2H+═Cu2++H2↑ D.向NaHCO3溶液中加入足量Ba(OH)2溶液:HCO3-+Ba2++OH-═H2O+BaCO3↓ 組卷:3引用:2難度:0.7 -
6.設NA為阿伏加德羅常數的值,下列敘述正確的是( )
A.7.8g Na2O2與足量水反應生成O2分子數為0.1NA B.50mL 18mol/L H2SO4溶液與足量的銅反應能產生SO2氣體分子數為0.45NA C.標準狀況下22.4L氯氣與足量的鐵反應,轉移電子數為3NA D.常溫常壓下,92g NO2氣體中含有的原子總數為6NA 組卷:5引用:2難度:0.8 -
7.下列敘述錯誤的是( )
A.13C和14C屬于同一種元素,它們互為同位素 B.1H和2H是不同的核素,它們的化學性質基本相同 C.14C和14N的質量數相等,它們的中子數不等 D.6Li和7Li的電子數相等,中子數也相等 組卷:42引用:5難度:0.9 -
8.下列排列順序正確的是( )
A.粒子半徑:Al3+>Mg2+>Na+ B.熱穩定性:HI>HBr>HCl>HF C.酸性:H2CO3<H2SO4<HClO4 D.堿性:Al(OH)3>Mg(OH) 2>NaOH 組卷:177引用:6難度:0.7 -
9.每種物質都既有離子鍵,又有共價鍵的一組物質是( )
A.NaOH、H2SO4、(NH4)2SO4 B.MgO、Na2SO4、NH4HCO3 C.Na2O2、NH4Cl、Na2SO4 D.HCl、Al2O3、MgCl2 組卷:82引用:11難度:0.7 -
10.下列金屬冶煉的反應原理,錯誤的是( )
A.2NaCl(熔融) 2Na+Cl2↑通電B.MgO+H2 Mg+H2O△C.Fe3O4+4CO 3Fe+4CO2高溫D.2HgO 2Hg+O2↑△組卷:332引用:19難度:0.9
二.填空題
-
30.經檢測某工廠的酸性廢水中所含離子及其濃度如下表所示:
(1)c(H+)=離子 Fe3+ Cu2+ SO42- Na+ H+ 濃度/(mol/L) 2×10-3 1×10-3 1×10-2 2×10-3 mol/L.
(2)為了減少污染并變廢為寶,工程師們設計了如下流程,回收銅和綠礬(FeSO4?7H2O).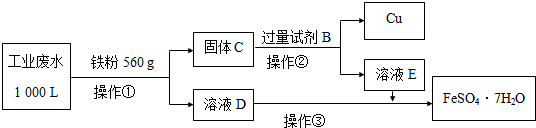
①工業廢水中加入鐵粉后,反應的離子方程式為:Fe+Cu2+═Fe2++Cu、、.
②試劑B是.
③操作③是蒸發濃縮、冷卻結晶、,最后用少量冷水洗滌晶體,在低溫下干燥.
④通過檢驗溶液D中Fe3+來判斷廢水中Fe3+是否除盡,實驗方法是.
⑤獲得的FeSO4?7H2O需密閉保存,原因是.
⑥上述1000L廢水經處理,可獲得 FeSO4?7H2O的物質的量是mol.組卷:104引用:6難度:0.5 -
31.實驗小組制備高鐵酸鉀(K2FeO4)并探究其性質。
資料:K2FeO4為紫色固體,微溶于KOH溶液;具有強氧化性,在酸性或中性溶液中快速產生O2,在堿性溶液中較穩定。
Ⅰ.制備K2FeO4(夾持裝置略)。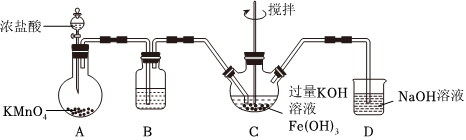
(1)A為氯氣發生裝置。A中化學反應的還原劑是。
(2)裝置B的作用是除雜,所用試劑為。
(3)C中得到紫色固體和溶液,C中主要反應的化學方程式為:。此反應表明:氧化性Cl2。(填“>”或“<”)FeO2-4
(4)C中除了發生(3)中的反應,還可能發生的化學的離子方程式為:。
Ⅱ.探究K2FeO4的性質。
用KOH溶液充分洗滌C中所得固體,再用KOH溶液將K2FeO4溶出,得到紫色溶液a。取少量a,滴加鹽酸,有Cl2產生。
(5)此實驗可證明氧化Cl-的物質只能是。用KOH溶液洗滌的目的是FeO2-4。
(6)此實驗得出Cl2和的氧化性強弱關系與制備實驗時得出的結論相反,原因是FeO2-4。組卷:56引用:7難度:0.5


