2021-2022學(xué)年江蘇省省級聯(lián)測高二(上)第二次聯(lián)考化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、單項(xiàng)選擇題:本題共9小題,每小題3分,共27分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的。
-
1.化學(xué)物質(zhì)、化學(xué)反應(yīng)與人類的生產(chǎn)、生活息息相關(guān),下列說法錯(cuò)誤的是( )
A.將食物保存在冰箱中,能夠減緩食物變質(zhì)的過程 B.SO2催化氧化時(shí),通過控制條件可使體積比為2:1的SO2和O2完全轉(zhuǎn)化成SO3 C.食醋是酸性是因?yàn)槠渲械腃H3COOH部分電離出CH3COO-和H+ D.活性污泥法處理污水時(shí),水中的含氮化合物轉(zhuǎn)化為N2的反應(yīng)屬于氧化還原反應(yīng) 組卷:25引用:2難度:0.7 -
2.下列說法錯(cuò)誤的是( )
A.冰在室溫下自動(dòng)融化成水,是熵增的過程 B.常溫下,Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O即可自發(fā)進(jìn)行的主要原因是該反應(yīng)為熵增的過程 C.ΔH>0的反應(yīng)在高溫下均可自發(fā)進(jìn)行 D.ΔH<0且ΔS>0的反應(yīng)在較低溫度下可自發(fā)進(jìn)行 組卷:75引用:2難度:0.6 -
3.工業(yè)上合成氮的反應(yīng)為N2(g)+3H2(g)?2NH3(g),下列說法錯(cuò)誤的是( )
A.反應(yīng)中斷裂1molN≡N鍵的同時(shí)形成6molN-H鍵 B.反應(yīng)達(dá)到平衡時(shí),反應(yīng)混合物中N2和NH3的體積比一定為1:2 C.反應(yīng)混合物中NH3的質(zhì)量分?jǐn)?shù)不再變化時(shí),反應(yīng)達(dá)到平衡狀態(tài) D.若在恒器、恒壓容器中由正向開始該反應(yīng),則在未達(dá)到平衡狀態(tài)前容器的體積逐漸減小 組卷:3引用:2難度:0.6 -
4.某溫度下,將含有H2和I2各0.10mol的氣態(tài)混合物充入容積為10L的密閉容器中,發(fā)生反應(yīng)H2(g)+I2(g)?2HI(g ),達(dá)到平衡后測得c(H2)=0.0080mol?L-1,則此溫度下該反應(yīng)的平衡常數(shù)為( )
A.0.25 B.0.5 C.2 D.4 組卷:6引用:1難度:0.7 -
5.反應(yīng)CO(g)+H2O(g)?CO2(g)+H2(g)ΔH=-41.2kJ?mol-1,是目前大規(guī)模制取氫氣的方法之一,在容積恒為2L的密閉容器中,將2.0molCO與8.0molH2O混合加熱到830℃發(fā)生上述反應(yīng),5min時(shí)達(dá)到平衡,CO的轉(zhuǎn)化為80%。下列說法錯(cuò)誤的是( )
A.5min內(nèi)的平均反應(yīng)速率v(H2)=0.16mol?L-1?min-1 B.該反應(yīng)的平衡常數(shù)計(jì)算式為K= 0.2mol?L-1×3.2mol?L-10.8mol?L-1×0.8mol?L-1C.達(dá)到平衡時(shí)反應(yīng)放出熱量為65.92kJ D.平衡時(shí)間容器中通入He增大壓強(qiáng),平衡不移動(dòng) 組卷:21引用:2難度:0.7
三、非選擇題:本題包括4小題,共57分。
-
16.可燃冰是天然氣水合物,可用CH4?xH2O表示.可燃冰的開采和利用有助于解決人類面臨的能源危機(jī).
(1)可燃冰在一定條件下能夠釋放出CH4氣體,該條件是(填“低溫”或“高溫”)、(填“低壓”或“高壓”).
(2)熔融碳酸鹽型燃料電池通常被稱為第二代燃料電池,以CH4為燃料時(shí),電池的工作原理如圖所示.
①CH4和H2O可在電池內(nèi)部經(jīng)催化重整反應(yīng)轉(zhuǎn)化為H2和CO,該反應(yīng)的化學(xué)方程式為.
②圖中電極(填“A”或“B”)為燃料電池的負(fù)極,正極上的電極反應(yīng)式為.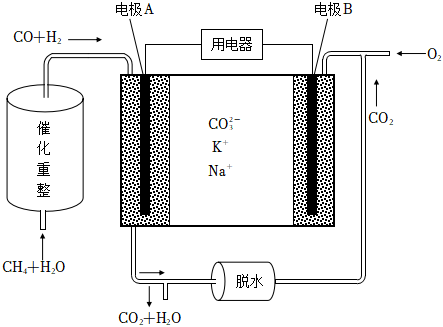
(3)在壓強(qiáng)為p的恒壓密閉容器中,CH4在電弧爐的作用下制取乙炔,化學(xué)方程式為2CH4?C2H2+3H2.表為反應(yīng)體系的物料衡算表.
①C2H2的產(chǎn)率α=成分 進(jìn)料 出料 純CH4 CH4 C2H2 H2 體積/m3 44.8 19.13 8.96 39.5 .
②出料中C2H2和H2的物質(zhì)的量之比并不等于1:3,可能的原因是.
③其他條件不變,若通過壓縮體積增大容器的壓強(qiáng),反應(yīng)的平衡常數(shù)K(填“增大”“減小”或“不變”).組卷:9引用:2難度:0.6 -
17.硒(Se)是動(dòng)物體必需的營養(yǎng)元素.也可用作光敏材料、電解錳的催化劑。
(1)硒是第34號元素,在元素周期表中位于第四周期ⅥA族,則其原子結(jié)構(gòu)示意圖為。
(2)硒與碲為伴生元素,其礦物經(jīng)處理后可獲得SeO2和TeO2的混合物,二者的物理性質(zhì)如下表.則分離該混合物最適宜的方法是。
(3)已知常溫下亞硒酸和硒酸的電離常數(shù)如下表:物質(zhì) 熔點(diǎn)/℃ 沸點(diǎn)/℃ 升華/℃ 溶解性 SeO2 340 684 315 易溶于水 TeO2 733 1260 450 微溶于水
①亞硒酸中硒元素的化合價(jià)為名稱 分子式 Ka1 Ka2 亞硒酸 H2SeO3 2.4×10-3 4.8×10-9 硒酸 H2SeO4 完全電離 1.2×10-2 。
②亞硒酸的二級電離常數(shù)Ka2=(寫出表達(dá)式),從結(jié)構(gòu)與性質(zhì)的關(guān)系解釋,亞硒酸的Ka1>Ka2的原因是。
③亞硒酸溶液中通入SO2可發(fā)生反應(yīng)制取硒單質(zhì),反應(yīng)的離子方程式為。
④電解亞硒酸溶液可制得硒酸,則電解時(shí)陽極的電極反應(yīng)式為。
⑤亞硒酸鈉溶液中滴加少量硒酸氫鈉溶液,反應(yīng)的離子方程式為HSeO4-+SeO32-?SeO42-+HSeO3-,此反應(yīng)的平衡常數(shù)K=。組卷:10引用:1難度:0.5


