2022-2023學年河南省洛陽市高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共10小題,每小題只有一個選項符合題意,每小題2分,共20分)
-
1.中國努力爭取2060年前實現碳中和。下列做法不利于實現碳中和的是( )
A.大力開發和利用風能等清潔能源 B.加強二氧化碳的捕集和再利用 C.一定條件下將二氧化碳轉為甲醇 D.用脫硫煤代替原料煤做燃料 組卷:13引用:1難度:0.6 -
2.下列做法的目的與改變化學反應速率無關的是( )
A.月餅包裝內放置除氧劑 B.青香焦和蘋果放一起催熟 C.食鹽中添加碘酸鉀 D.紅薯放在地窖中保存 組卷:11引用:1難度:0.6 -
 3.下列反應的能量變化與示意圖不相符的是( )
3.下列反應的能量變化與示意圖不相符的是( )A.鹽酸和碳酸氫鈉的反應 B.灼熱的炭與水蒸氣的反應 C.生石灰與水的反應 D.工業上煅燒石灰石的反應 組卷:13引用:1難度:0.7 -
4.下列熱化學方程式正確的是( )
A.甲烷的燃燒熱為ΔH=-890.3kJ/mol,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)═CO2(g)+2H2O(g)ΔH=-890.3kJ/mol B.500℃、30MPa下,將14gN2和3gH2置于密閉容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式中N2(g)+3H2(g)?2NH3(g)ΔH=-38.6kJ/mol C.已知H+(aq)+OH-(aq)═H2O(1)ΔH=-57.3kJ/mol,則稀硫酸和稀Ba(OH)2溶液反應的反應熱ΔH=2×(-57.3)kJ/mol D.25℃、101kPa下,1gH2燃燒生成液態水放熱142.9kJ,其熱化學方程式為H2(g)+ O2(g)═H2O(l)ΔH=-285.8kJ/mol12組卷:15引用:1難度:0.7 -
 5.298K、101kPa時,HCN(g)?HNC(g)異構化反應過程的能量變化如圖所示。下列說法正確的是( )
5.298K、101kPa時,HCN(g)?HNC(g)異構化反應過程的能量變化如圖所示。下列說法正確的是( )A.HNC比HCN穩定 B.正反應的活化能小于逆反應的活化能 C.該異構化反應的ΔH=+59.3kJ?mol-1 D.使用催化劑,可以改變反應的反應熱 組卷:6引用:5難度:0.5 -
6.在氣體反應中,能使反應物中活化分子數和活化分子百分數都增大的方法有( )
①增大反應物的濃度
②升高溫度
③增大壓強
④加入催化劑A.①②③④ B.②④ C.②③ D.①② 組卷:20引用:6難度:0.7 -
7.在常溫常壓下,向FeCl3溶液中滴入KSCN溶液,發生以下反應:FeCl3+3KSCN?Fe(SCN)3+3KCl,所得溶液顯紅色。改變下列條件,能使平衡逆向移動的是( )
A.向溶液中加入少量NaCl晶體 B.向溶液中加入少量水 C.向溶液中滴入數滴濃FeCl3溶液 D.向溶液中加入少量KCl固體 組卷:8引用:1難度:0.6 -
8.下列有關化學反應速率的說法中,正確的是( )
A.100mL2mol/L鹽酸與鋅反應時,加入少量NaCl溶液,生成氫氣的速率不變 B.反應2CO+2NO?N2+2CO2,加入合適的催化劑,CO的生成速率和消耗速率都加快 C.合成氨反應是一個放熱反應,升高溫度,正反應速率減慢,逆反應速率加快 D.用鐵片和稀硫酸反應制取氫氣時,為加快反應速率可將稀硫酸改為濃硫酸 組卷:14引用:1難度:0.6
三、填空題(本題共4小題,共50分)
-
23.氮是一種重要的元素,含氮化合物是化工、能源、環保等領域的研究熱點。回答下列問題:
(1)已知:N2(g)+3H2(g)?2NH3(g)ΔH=-92.4kJ/mol
2N2(g)+2O2(g)?4NO(g)ΔH=+360kJ/mol
2H2(g)+O2(g)?2H2O(l)ΔH=-571.6kJ/mol
試寫出表示氨氣的燃燒熱的熱化學方程式:。
(2)已知:合成尿素CO(NH2)2的反應為2NH3(g)+CO2(g)?H2O(1)+CO(NH2)2(s)ΔH=-134kJ/mol。向恒容密閉容器中按物質的量之比4:1充入NH3和CO2,使反應進行,保持溫度不變,測得CO2的轉化率隨時間的變化情況如圖所示。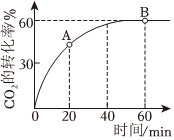
①若用CO2的濃度變化表示反應速率,則A點的逆反應速率B點的正反應速率(填“>”“<”或“=”)。
②下列敘述中不能說明該反成達到平衡狀態的是(填選項字母)。
A.體系壓強不再變化
B.氣體平均摩爾質量不再變化
C.NH3的消耗速率和CO2的消耗速率之比為2:1
D.固體質量不再發生變化
③工業上合成尿素時,既能加快反應速率,又能提高原料利用率的措施有(填選項字母)。
A.升高溫度
B.充入氮氣
C.將尿素及時分離出去
D.增大反應體系的壓強
(3)傳統的尿素生產,以二氧化碳和氨在高溫、高壓下,合成、轉化得到,工藝耗能較高,且產率較低。最近我國科學家發現TiO2納米片負載的Pd-Cu合金納米顆粒電催化劑可以將水溶液中的CO2和N2直接轉化為尿素(反應機理如圖所示,*表示催化劑活性中心原子)。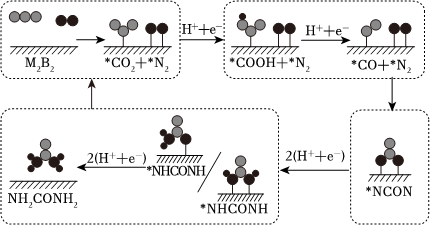
根據以上反應機理,*CO2→*COOH的過程中,斷裂的是(填“極性鍵”或“非極性鍵”,下同),形成的是。與傳統生產工藝相比,這種新方法的優點是(答出一點即可)。
(4)氨催化氧化時會發生下列兩個競爭反應Ⅰ、Ⅱ。
反應Ⅰ:4NH3(g)+5O2(g)4NO(g)+6H2O(g);Pt/Ru高溫
反應Ⅱ:4NH3(g)+3O2(g)2N2(g)+6H2O(g)。Cu2/TiO2高溫
為分析某催化劑對該反成的選擇性,在1L密閉容器中充入1molNH3和2molO2,測得有關物質的量關系如圖: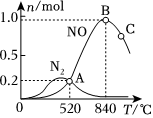
該催化劑在高溫時選擇反應(填“Ⅰ”或“Ⅱ”)。組卷:15引用:1難度:0.7 -
24.我國提出爭取在2030年前實現碳達峰,2060年前實現碳中和,這對于改善環境、實現綠色發展至關重要。因此,研發CO2利用技術,降低空氣中CO2的含量成為研究熱點。當前,科學家成功利用CO2和H2合成了CH3OH,這對節能減排、降低碳排放具有重大意義。回答下列問題:CO2催化加氫制甲醇是極具前景的資源化研究領域,主要反應有:
ⅰ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH1=-49.4kJ?mol
ⅱ.CO2(g)+H2(g)?CO(g)+H2O(g)ΔH2=+41.2kJ?mol
ⅲ.CO(g)+2H2(g)?CH3OH(g)ΔH3
(1)已知反應i速率方程為v正=k正?x(CO2)?x3(H2),v逆=k逆?x(CH3OH)?x(H2O),k正、k逆均為速率常數且只與溫度有關,x為物質的量分數。則反應ⅰ用物質的量分數表示的平衡常數Kx=(用k正、k逆表示;Kx指平衡時用各物質的物質的量分數來代替該物質的平衡濃度來計算平衡常數的一種新的表達式)。
(2)5MPa時,往某密閉容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反應達到平衡時,測得各組分的物質的量分數隨溫度變化的曲線如圖中所示。
①圖甲中X代表(填化學式)。
②250℃時反應ⅱ的K1(填“>”“<”或“=”)。
③下列措施中,一定無法提高甲醇產率的是(填字母)。
A.加入適量CO
B.增加CO2
C.循環利用原料氣
D.升高溫度
(3)在10MPa下,將H2、CO按一定比例投料,恒壓下平衡狀態時各組分的物質的量與溫度的關系如圖乙所示。曲線b代表的物質為(填化學式)。溫度為700K時,該反應的平衡常數K=(MPa)2(結果用分數表示)。
(4)研究表明,CO2與H2在催化劑作用下,發生反應ⅰ合成CH3OH時會發生副反應(反應ⅱ)。將一定量的CO2和H2通入剛性的密閉容器中,CO2的平衡轉化率和甲醇的選擇率隨溫度的變化趨勢如圖所示,已知:CH3OH的選擇率x=×100%。隨著溫度的升高,CO2的平衡轉化率增加但甲醇的選擇率降低,請分析其原因:轉化為CH3OH的(CO2)消耗的(CO2)。 組卷:40引用:1難度:0.3
組卷:40引用:1難度:0.3


