2022-2023學年重慶市縉云教育聯盟高一(下)期末化學試卷
發布:2024/8/17 2:0:1
-
1.下列裝置或過程能實現電能轉化為化學能的是( )
A.風力發電 B.火力發電 C.燃料電池 D.電解水 組卷:36引用:1難度:0.8 -
2.下列說法不正確的是( )
A.檢驗淀粉是否水解可用新制的氫氧化銅懸濁液 B.乙醚具有麻醉作用,可通過乙醇在濃硫酸的催化下發生消去反應制得 C.合成纖維是由原料通過縮聚反應合成的高分子化合物,其原料不含纖維素 D.脂肪在堿性溶液在發生的水解屬于皂化反應,其水解產物可用于制皂 組卷:35引用:2難度:0.5 -
3.城市居民用的石油氣主要成分是丁烷,在使用的過程中,常有一些雜質以液態沉積于鋼瓶中,這種雜質是( )
A.丙烷和丁烷 B.乙烷和丙烷 C.乙烷和戊烷 D.戊烷和己烷 組卷:144引用:4難度:0.7 -
4.下列實驗操作能達到其對應目的是( )
編號 實驗操作 目的 A 向2mL 1mol?L-1NaOH溶液中先加入3滴1mol?L-1MgCl2溶液,再加入3滴1mol?L-1 FeCl3溶液 證明Mg(OH)2沉淀可以轉化為Fe(OH)3沉淀 B 向淀粉溶液中加入稀硫酸,水浴加熱一段時間后,再加入氫氧化鈉溶液至溶液呈堿性,最后加入新制的氫氧化銅并加熱 驗證淀粉已水解 C 將1mL KSCN溶液與1mL同濃度FeCl3溶液充分混合;再繼續加入KSCN溶液 證明溶液中存在平衡:
Fe3++3SCN═Fe(SCN)3D 將乙醇與濃硫酸共熱制得的氣體,直接通入溴水中 檢驗產物是乙烯氣體 A.A B.B C.C D.D 組卷:34引用:2難度:0.9 -
5.對于反應A(g)+3B(g)?2C(g),下列各數據表示不同條件下的反應速率,其中反應進行得最快的是( )
A.v(A)=0.02 mol/(L?s) B.v(B)=0.03 mol/(L?s) C.v(B)=0.90 mol/(L?min) D.v(C)=0.60 mol/(L?min) 組卷:93引用:6難度:0.9 -
6.按照綠色化學的思想,最理想的“原子經濟性反應”就是反應物的原子全部轉化為期望的最終產物。下列工業生產涉及的反應中最符合“原子經濟性反應”的是( )
A.鈉與氧氣反應制取過氧化鈉 B.氯氣與石灰乳反應制取次氯酸鈣 C.一氧化碳還原氧化鐵冶煉鐵 D.二氧化硅與焦炭反應制取粗硅 組卷:71引用:5難度:0.6
-
17.煤是重要的能源,也是生產化工產品的重要原料。隨著人類社會的飛速發展,化石能源大量消耗,人類已經面臨較嚴重的能源危機。為此,提高能源的利用率和開發更多的新能源顯得相當重要。如圖是煤化工產業鏈的一部分。
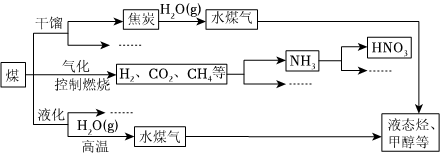
請回答:
(1)任意列舉兩項新能源。
(2)上述處理煤的過程屬于(填“物理”或“化學”)變化。
(3)煤和石油等化石燃料燃燒排放的大量二氧化碳會引起全球氣候變暖。一種新的處理方法是將二氧化碳氣體通入含有長石(地殼中最常見的礦石,含量高達60%)成分的水溶液里,其中一種反應的化學方程式是:KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2↓,則X的名稱是。
(4)在煤燃燒前需對煤進行脫硫處理。煤的某種脫硫技術的原理如圖所示: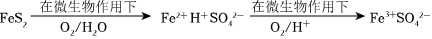
這種脫硫技術稱為微生物脫硫技術。該技術的兩步反應的化學方程式依次是。
(5)工業上主要采用氨氧化法生產硝酸,如圖是氨氧化率與氨—空氣混合氣中氧氨比的關系。其中直線表示反應的理論值;曲線表示生產實際情況。當氨氧化率達到100%,理論上γ[]=1.25,實際生產要將γ值維護在1.7~2.2之間,原因是n(O2)n(NH3)。[溫馨提示:n(O2)是可以認為是表示氧氣分子堆積數目的一種物理量,即n(O2)值越大,說明氧分子數目越多]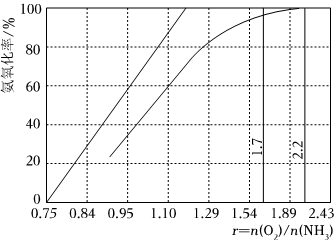 ?組卷:40引用:1難度:0.6
?組卷:40引用:1難度:0.6 -
18.甲酸鈣用途廣泛,可用于高硫煙氣脫硫助劑,也可作為制備草酸的中間體.據最新文獻,氫氧化鈣碳基化合成甲酸鈣的反應如下:
2CO+Ca(OH)2═Ca(HCOO)2 反應1
(1)反應體系中存在以下兩個競爭反應
CO(g)+H2O(g)?HCOOH(g)△H=-28.8kJ/moL 反應2
CO(g)+H2O(g)?CO2(g)+H2(g)△H=+41.2kJ/moL 反應3
①二氧化碳與氫氣直接合成甲酸的熱化學反應方程式為.
②為了更有利于生成甲酸鈣,應選擇的反應條件是較低的溫度和(填編號).
A.催化劑B.低壓C.高壓
(2)如圖1是反應2和反應3,lnK與溫度T的關系;同一條件時反應2的K(填“大于”或“小于”)反應3的K,這對于(填“反應2”或“反應3”)不利的.
(3)以氫氧化鈣初始密度為0.097g/mL、CO的分壓為3.0MPa條件下催化反應,以氫氧化鈣轉化率Y%為坐標,時間為橫坐標得到如圖2象;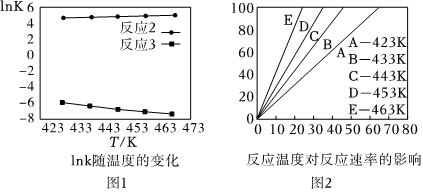
①根據圖象選擇合適的反應溫度;理由是.
②當Y%為100%時,產物中甲酸鈣與碳酸鈣的質量比為50:1,氫氧化鈣有%轉化為甲酸鈣.組卷:23引用:2難度:0.9


