2021-2022學年北京市石景山區第九中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題。(本題共25小題,每小題2分,共50分)
-
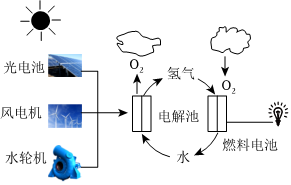 1.下列氫能的制取、貯存及利用過程(如圖所示),未涉及的能量轉化形式是( )
1.下列氫能的制取、貯存及利用過程(如圖所示),未涉及的能量轉化形式是( )A.電能轉化為光能 B.機械能轉化為電能 C.電能轉化為化學能 D.光能轉化為化學能 組卷:22引用:7難度:0.8 -
2.下列有關化學能與熱能說法正確的是( )
A.需要加熱的化學反應都是吸熱反應 B.同溫同壓下,反應H2(g)+Cl2(g)=2HCl(g),在光照和點燃條件下的△H相同 C.焓是與內能有關的物理量,任何條件下,反應的熱效應等于焓變 D.等質量的硫蒸氣和硫粉分別與足量氧氣反應生成SO2氣體,硫粉放出的熱量多 組卷:17引用:1難度:0.7 -
3.下列措施能降低化學反應的活化能,提高反應速率的是( )
A.增大反應物濃度 B.加催化劑 C.加壓 D.升溫 組卷:22引用:9難度:0.9 -
4.已知:H2(g)+F2(g)═2HF(g)△H=-546.6kJ?mol-1,下列說法中不正確的是( )
A.44.8 L氟化氫氣體分解成22.4 L的氫氣和22.4 L的氟氣吸收546.6 kJ熱量 B.1 mol氫氣與1 mol氟氣反應生成2 mol液態氟化氫放出的熱量大于546.6 kJ C.相同條件下,1 mol氫氣與1 mol氟氣的能量總和高于2 mol氟化氫氣體的能量 D.2 mol H-F鍵的鍵能比1 mol H-H鍵和1 mol F-F 鍵的鍵能之和大546.6 kJ 組卷:18引用:3難度:0.9 -
5.一定條件下,在容積為1L的密閉容器中發生反應:N2(g)+3H2(g)?2NH3(g),1min后測得生成0.06molNH3,則該段時間內用N2來表示的化學反應速率為( )
A.0.01mol?L-1?min-1 B.0.02mol?L-1?min-1 C.0.03mol?L-1?min-1 D.0.06mol?L-1?min-1 組卷:28引用:5難度:0.7 -
6.已知煤炭的燃燒熱為393.5kJ/mol,氫氣的燃燒熱為285.8kJ/mol,一氧化碳的燃燒熱為283.0kJ/mol。某同學發現在灼熱的煤炭上灑少量水,煤爐中會產生淡藍色火焰,煤炭燃燒更旺,因此該同學得出結論“煤炭燃燒時加少量水,可使煤炭燃燒放出更多的熱量。”下列有關說法正確的是( )
A.反應2H2(g)+O2(g)=2H2O(g)的△H<-571.6kJ?mol-1 B.CO燃燒的熱化學方程式為2CO(g)+O2(g)=2CO2(g)△H=-283.0kJ?mol-1 C.“煤炭燃燒得更旺”是因為少量固體碳與水反應生成了可燃性氣體 D.因285.8kJ?mol-1+283.0kJ?mol-1>393.5kJ?mol-1,故該同學結論是對的 組卷:63引用:5難度:0.8 -
7.已知熱化學方程式:
C(金剛石,s)+O2(g)=CO2(g)△H1 C(石墨,s)+O2(g)=CO2(g)△H2C(石墨,s)=C(金剛石,s)△H3=1.9kJ/mol
下列說法正確的是( )A.石墨轉化成金剛石的反應是吸熱反應 B.金剛石比石墨穩定 C.△H3=△H1-△H2 D.△H1>△H2 組卷:19引用:5難度:0.7 -
8.工業上常使用電解精煉法將粗銅提純.在電解精煉銅時( )
A.粗銅接電源負極 B.純銅作陽極 C.雜質都將以單質形式沉積到池底 D.純銅片增重2.56 g,電路中通過電子為0.08 mol 組卷:12引用:5難度:0.7 -
9.觀察下列幾個裝置示意圖,有關敘述不正確的是( )
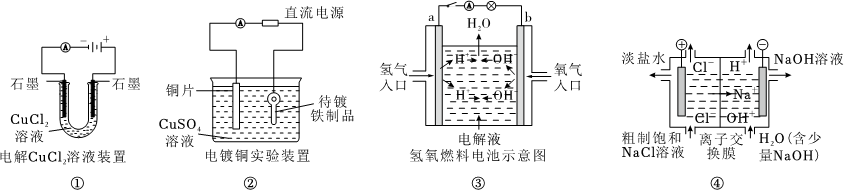
A.裝置①中陰極上析出紅色固體 B.裝置②的待鍍鐵制品應與電源正極相連 C.裝置③中外電路電子由 a 極流向 b 極 D.裝置④的離子交換膜允許陽離子自由通過 組卷:158引用:3難度:0.8
二、填空題(本大愿共4小題,共50分)
-
28.電解原理在化學工業中有廣泛應用.
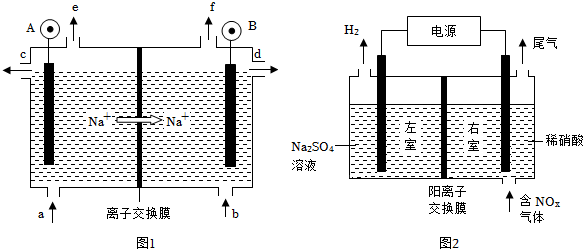
(1)電解食鹽水是氯堿工業的基礎.目前比較先進的方法是陽離子交換膜法,電解示意圖如圖1所示,圖中的陽離子交換膜只允許陽離子通過,請回答以下問題:
①圖中A極要連接電源的(填“正”或“負”)極.
②精制飽和食鹽水從圖中位置補充,氫氧化鈉溶液從圖中位置流出.(選填“a”、“b”、“c”、“d”、“e”或“f”)
③電解總反應的離子方程式是.
(2)電解法處理含氮氧化物廢氣,可回收硝酸,具有較高的環境效益和經濟效益.實驗室模擬電解法吸收NOx的裝置如圖2所示(圖中電極均為石墨電極).若用NO2氣體進行模擬電解法吸收實驗.
①寫出電解時NO2發生反應的電極反應.
②若有標準狀況下2.24L NO2被吸收,通過陽離子交換膜(只允許陽離子通過)的H+為mol.
(3)為了減緩鋼制品的腐蝕,可以在鋼制品的表面鍍鋁.電解液采用一種非水體系的室溫熔融鹽,由有機陽離子、A12Cl7-和AlCl4-組成.
①鋼制品應接電源的極.
②已知電鍍過程中不產生其他離子且有機陽離子不參與電極反應,陰極電極反應式為.
③若改用AlCl3水溶液作電解液,則陰極電極反應式為.組卷:126引用:6難度:0.3 -
29.火力發電廠釋放出大量氣體會造成環境污染。對燃煤廢氣進行處理,可實現綠色環保、廢物利
用等目的。
(1)CO可以與H2O(g)發生反應:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
在甲、乙、丙三個恒容密閉容器中,起始時按照下表進行投料,在800℃時達到平衡狀態,K=1.0。
①該反應的平衡常數表達式為起始物質的量/mol 甲 乙 丙 n(H2O) 0.10 0.20 0.20 n(CO) 0.10 0.10 0.20 。
②平衡時,丙容器中H2O的物質的量是mol,甲容器中CO的轉化率是。
③丙容器中,其它條件不變時,溫度(升高或降低),CO的平衡轉化率升高。
(2)除去氮氧化物:
①利用甲烷催化還原NO:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
甲烷直接將NO2還原為N2的熱化學方程式為。
②也可用氨氣與之發生反應:NOx+NH3→N2+2H2O.現有NO2和NO的混合氣體3.0L,和3.4L(同溫同壓下)NH3反應,恰好使其全部轉化為氮氣,則原混合氣體中,NO2和NO的體積比是。組卷:8引用:2難度:0.5


