2023年天津市河?xùn)|區(qū)高考化學(xué)二模試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(共36分。本題包括12小題,每小題3分,共36分。每小題只有一個(gè)選項(xiàng)符合題意)
-
1.化學(xué)與生活息息相關(guān),下列說法中錯(cuò)誤的是( )
A.新型冠狀病毒主要由RNA和蛋白質(zhì)組成,可采用高溫、紫外線、75%的乙醇等有效滅活 B.TCL公司的12CMini LED智屏由3840顆微米級(jí)芯片組成,芯片的主要成分為SiO2 C.月球新礦物“嫦娥石”是一種磷酸鹽礦物(含鎂和鐵),它不易溶于水 D.某專業(yè)足球由20片紋理聚氨酯(PU)熱粘合而成,聚氨酯(PU)是有機(jī)高分子材料 組卷:71引用:4難度:0.7 -
2.下列有關(guān)說法正確的是( )
A.Na2O和Na2O2固體中陽離子和陰離子個(gè)數(shù)比都是2:1 B.CO2和SiO2的化學(xué)鍵類型和晶體類型相同 C. 和NH3都可以做為配合物的配體NH+4D.Al和N的原子軌道都有3個(gè)單電子 組卷:69引用:2難度:0.7 -
3.海帶提碘過程為海帶灼燒為海帶灰,用水浸取I-,過濾得含有I-的溶液,加氧化劑將I-氧化為I2,萃取分液,得碘的有機(jī)溶液,蒸餾得碘單質(zhì)。上述操作中,不需要用到的儀器為( )
A. 
B. 
C. 
D.  組卷:61引用:2難度:0.5
組卷:61引用:2難度:0.5 -
4.下列敘述錯(cuò)誤的是( )
A. 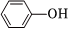 和
和 互為同系物
互為同系物B. O、188O互為同位素168C.S2與S8互為同素異性體 D.丙酸和甲酸乙酯互為同分異構(gòu)體 組卷:70引用:1難度:0.9 -
5.維生素C是重要的營養(yǎng)素,又稱“抗壞血酸”,在人體內(nèi)可發(fā)生如圖轉(zhuǎn)化:
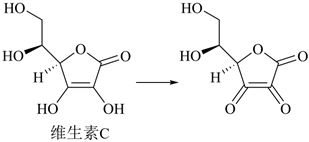
下列有關(guān)維生素C的說法不正確的是( )A.含有羥基、酯基、碳碳雙鍵三種官能團(tuán) B.在該轉(zhuǎn)化過程中被氧化 C.堿性環(huán)境中更易被破壞 D.易溶于水,因此飲用鮮榨果汁比直接食用水果效果好 組卷:131引用:4難度:0.7
二、非選擇題,共64分
-
15.某實(shí)驗(yàn)小組擬在實(shí)驗(yàn)室模擬工業(yè)合成氨,并進(jìn)行氨的催化氧化。
Ⅰ.實(shí)驗(yàn)室模擬合成氨的流程如圖:

已知實(shí)驗(yàn)室可用飽和亞硝酸鈉(NaNO2)溶液與飽和氯化銨溶液經(jīng)加熱后反應(yīng)制取氮?dú)狻?br />(1)如圖中制取氮?dú)獾难b置是;制取氫氣的裝置是。
(2)氮?dú)夂蜌錃馔ㄟ^甲裝置,甲裝置的作用除了將氣體混合外,還有、。
(3)原料氣通入合成裝置合成氨的化學(xué)反應(yīng)方程式是。
Ⅱ.氨的催化氧化
(4)乙裝置的名稱是。
(5)氨合成器出來經(jīng)冷卻的氣體連續(xù)通入乙裝置的水中吸收氨,(“會(huì)”或“不會(huì)”)發(fā)生倒吸,原因是。
(6)用乙裝置吸收一段時(shí)間氨后,再通入空氣,同時(shí)將經(jīng)加熱的鉑絲插入乙裝置的錐形瓶內(nèi),能使鉑絲保持紅熱的原因是,錐形瓶中還可觀察到的現(xiàn)象是。
(7)反應(yīng)結(jié)束后錐形瓶內(nèi)的溶液中含有H+、OH-、、離子。組卷:144引用:1難度:0.7 -
16.硫酸銨焙燒浸出液水解制備偏鈦酸[TiO(OH)2]可回收鈦。
已知:i.一定條件下,Ti4+水解方程式:Ti4++3H2O?TiO(OH)2+4H+
ii.一定溫度下:Ksp[Fe(OH)2]=4.9×10-17;Ksp[Fe(OH)3]=2.6×10-39
Ⅰ.水解制備偏鈦酸:浸出液中含F(xiàn)e3+、Ti4+等,先向其中加入還原鐵粉,然后控制水解條件實(shí)現(xiàn)Ti4+水解制備偏鈦酸。
(1)用化學(xué)用語表示(NH4)2SO4溶液呈酸性的原因。
(2)浸出液(pH=2)時(shí):①Fe2+轉(zhuǎn)化為Fe(OH)2沉淀需要的濃度為mol?L-1;Fe3+轉(zhuǎn)化為Fe(OH)3沉淀需要的濃度為mol?L-1。
②若雜質(zhì)離子沉淀會(huì)降低鈦水解率。從定量角度解釋加入還原鐵粉的目的。
(3)一定條件下,還原鐵粉添加比對(duì)鈦水解率的影響如圖1所示。當(dāng)還原鐵粉添加比大于1時(shí),鈦水解率急劇下降,解釋其原因。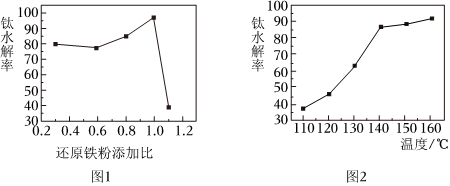
已知:還原鐵粉添加比=;n鐵粉為還原鐵粉添加量,n理論為浸出液中Fe3+全部還原為Fe2+所需的還原鐵粉理論量。n鐵粉n理論
(4)一定條件下,溫度對(duì)鈦水解率的影響如圖2所示。結(jié)合化學(xué)平衡移動(dòng)原理解釋鈦水解率隨溫度升高而增大的原因。
Ⅱ.電解制備鈦:偏鈦酸煅燒得到二氧化鈦(TiO2),運(yùn)用電化學(xué)原理在無水CaCl2熔鹽電解質(zhì)中電解TiO2得到海綿鈦,裝置如圖3所示。
(5)電極X連接電源(填“正”或“負(fù)”)極;寫出電極Y上發(fā)生的電極反應(yīng)式。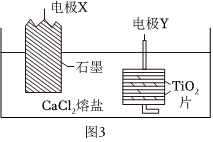 組卷:144引用:1難度:0.7
組卷:144引用:1難度:0.7


