2020-2021學年安徽省合肥市新東方學校高二(下)月考化學試卷0012
發布:2025/1/6 7:30:2
一、選擇題。共54分。共18小題,每小題3分。每小題只有一個選項符合題意。答案填涂到答題卡上。
-
1.下列判斷正確的是:①氫氧化鈉是電解質;②強電解質溶液的導電性一定比弱電解質溶液導電性強;③硫酸鋇難溶于水,所以硫酸鋇是非電解質;④蔗糖易溶于水,所以是電解質; ⑤氯氣溶于水后導電,所以Cl2是電解質。以上判斷正確的個數有( )
A.1個 B.2個 C.3個 D.4個 組卷:108引用:1難度:0.6 -
2.pH相同的氨水、氫氧化鈉和氫氧化鋇溶液,分別用蒸餾水稀釋到原來的X倍、Y倍、Z倍,稀釋后三種溶液的pH同,則X、Y、Z的關系是( )
A.X=Y=Z B.X>Y=Z C.X<Y=Z D.X=Y<Z 組卷:77引用:31難度:0.7 -
3.在-50℃時液氨中有2NH3(液)?NH4++NH2-電離平衡關系,兩離子的平衡濃度均為1×10-15mol?L-1,下列對-50℃時液氨的電離平衡常數的表達中正確的是( )
A.電離平衡常數是1×10-15 B.不加入其他物質,液氨中c(NH4+)=c(NH2-) C.降低溫度,其電離平衡常數數值增加 D.此液氨中放入NH4Cl,其電離平衡常數的數值增加 組卷:32引用:2難度:0.6 -
4.下列有關溶液的敘述錯誤的是( )
A.常溫下的醋酸銨溶液呈中性,則溶液中c(H+)=c(OH-)=10-7mol?L-1 B.常溫下某溶液中由水電離出來的c(OH-)=1.0×10-12 mol?L-1,則該溶液可能為NaOH溶液 C.相同溫度下,1 mol?L-1醋酸溶液與0.5 mol?L-1醋酸溶液中,c(H+)之比小于2:1 D.導電性強的溶液中自由移動離子數目一定比導電性弱的溶液中自由移動離子數目多 組卷:4引用:4難度:0.9 -
5.已知25℃時有關弱酸的電離平衡常數:
弱酸化學式 CH3COOH HCN H2CO3
電離平衡常數(25℃) 1.8×10-5 4.9×10-10 K1=4.3×10-7;K2=5.6×10-11
則下列有關說法正確的是( )A.等物質的量濃度的各溶液pH關系為:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) B.amol?L-1HCN溶液與bmol?L-1NaOH溶液等體積混合后,所得溶液中c(Na+)>c(OH-)則a一定大于b C.冰醋酸中逐滴加水,則溶液的導電性、醋酸的電離度、pH均先增大后減小 D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) 組卷:7引用:1難度:0.9 -
6.常溫下,取濃度相同的NaOH和HCl溶液,以3:2體積比相混合,所得溶液的pH等于12,則原溶液的濃度為( )
A.0.01 mol/L B.0.017 mol/L C.0.05 mol/L D.0.50 mol/L 組卷:406引用:7難度:0.9 -
7.表達下列過程的化學用語錯誤的是( )
A.將少量硫酸鋁鉀溶于水中:KAl(SO4)2═K++Al3++2SO42-,Al3++3H2O?Al(OH)3+3H+ B.小蘇打在水中的水解:HCO3-+H2O?CO32-+H3O+ C.NaHSO4在水中的電離:NaHSO4═Na++H++SO42- D.氯氣和水的反應:Cl2+H2O?H++Cl-+HClO 組卷:17引用:1難度:0.7
二、非選擇題。共46分
-
 21.研究CO2的綜合利用對促進“低碳經濟”的發展有重要意義。
21.研究CO2的綜合利用對促進“低碳經濟”的發展有重要意義。
(1)工業上以CO2、NH3為原料生產尿素[CO(NH2)2],反應實際為兩步進行:
Ⅰ:2NH3(g)+CO2(g)?H2NCOONH4(s)△H=-272kJ?mol-1
Ⅱ:H2NCOONH4(s)?CO(NH2)2(s)+H2O(g)△H=+138kJ?mol-1
已知:H2O(I)═H2O(g)△H=+44kJ?mol-1
①請寫出以NH3、CO2為原料,合成尿素和液態水的熱化學方程式。
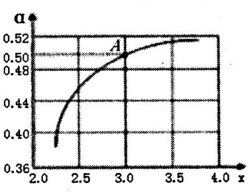
②T1℃時,在1L的密閉容器中充入CO2和NH3模擬工業生產,n(NH3)/n(CO2)=x,如圖是CO2平衡轉化率(α)與x的關系。求圖中A點NH3的平衡轉化率α=%。
③當x=1.0時,若起始的壓強為p0kPa,水為液態,平衡時壓強變為起始的.則該反應的平衡常數Kp=12(kPa)-3(KP為以分壓表示的平衡常數)。
(2)用CO2和H2合成甲醇:3H2(g)+CO2(g)?CH3OH(g)+H2O(g)
△H=-49.0kJ?mol-1.在T℃時,甲、乙、丙三個2L的恒容密閉容器中,按不同方式投入反應物,測得平衡時有關數據如表:
①甲容器10s達到平衡時測得x=39.2,則甲中CO2的平均反應速率容器 甲 乙 丙 起始反應物投入量 3molH2(g)1molCO2(g) 1molCH3OH(g)1molH2O(g) 2molCH3OH(g)
2molH2O(g)平
衡
數
據c(CH3OH)/mol?L-1 C1 C2 c3 反應的能量變化/kJ x y z 體系壓強/Pa P1 P2 P3 反應物轉化率 a1 a2 a3 。
②下列說法正確的是(填字母編號)。
A.2c1<c3B.z<2yC.p3>2p2D.a1+a3>1
(3)用NaOH溶液做碳捕捉劑可獲得化工產品Na2CO3.常溫下若某次捕捉后得到pH=10的溶液,則溶液中c(CO32-):c(HCO3-)=[K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11],溶液中c(Na+)c(HCO3-)+2c(CO32-)(填“>”“=”或“<”)。組卷:19引用:3難度:0.6 -
22.已知:稀堿液中鹵苯難水解.芳香族化合物C的分子式為C9H9OCl.C分子中有二條側鏈,苯環上一氯代物只有二種,其核磁共振氫譜圖中有五個吸收峰,吸收峰的面積之比為1:2:2:2:2.在一定條件下,由物質C可發生如圖所示的轉化:

(1)B→A的反應類型是;H的結構簡式是;
(2)C分子中最少有個碳原子共面,其含氧官能團的名稱;
(3)寫出下列化學方程式:D與銀氨溶液反應;E→I;
(4)D的一種同系物W分子式為C8H8O2.則符合下列條件的W的同分異構體共有種.條件:①屬于芳香族化合物 ②遇FeCl3溶液不變紫色 ③1mol W可與含2mol NaOH的溶液反應.組卷:15引用:3難度:0.1


